|
B.7 ���M���D���������� Febrile Neutropenia |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�͂��߂� |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�{���́u���M���D���������ǃK�C�h���C��������3�ŁiFN�K�C�h���C����3�Łj�ɏ�������B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
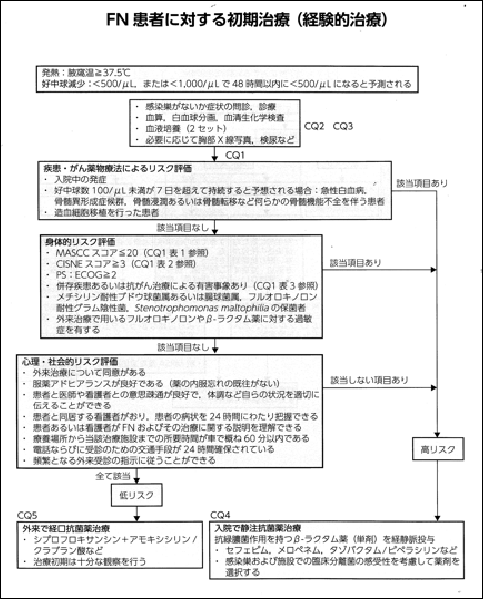
B.7-1 FN���N�������ꍇ�̕]�� |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
��` ·
�������D������500/��L�����A�܂���1,000/��L������48���Ԉȓ���500/��L�����Ɍ�������Ɨ\��������ԂŁA���|��37.5���ȏ�i���o����38���ȏ�j�̔��M�������� �N����ˁE�a�������� ·
�D�������̐�ΓI�Ȍ��ۂ�w�i�Ƃ��ĔS���ʂ̏�ۂ̃g�����X���P�[�V�����ɂ��S�g�����ǂɈڍs����B�N����˂͕s���ȏꍇ�������A�����������̓����40〜50%�ɗ��܂�B ·
���������ǂ̕a���������̓���́A�O�����z������60〜70%�A�O�����A������20〜30���A�^��10%�ł���i�\�P�j�B ·
�x���́A���@�㑁���i48〜72���Ԉȓ��j��Streptococcus
pneumoniae��Haemophilus influenzae�Ȃǂ̎s���x���Ɋւ���a���������ɂ����̂��������A����ȍ~�́A�O�����A�����ہiPseudomonas aeruginosa, Klebsiella
pneumoniae, Enterobacter cloacae, Serratia marcescens�Ȃǁj�A�^�ہiAspergillus spp. �j�ɂ����̂������B �\1�D���������ǂŕp�x�̍����a��������
�d�lj����X�N�]���@��B.7-2
FN�̎��Ái�O�����Áj�̍����Q�ƁB ·
���l���҂ɑ��āAMASCC�X�R�A�i�\2�j�ACISNE�X�R�A�i�\3�j�͏d�lj����X�N�̒Ⴂ���҂̓���ɗL�p�ł���B�������A�O�����Âɍۂ��ẮA�����̃��X�N�X�R�A�ɉ����āA��������т���Ö@�̃��X�N�A�g�̓I���X�N�A�S���E�Љ�I���X�N���l�����ׂ��ł���i�ア�����j�B ·
��X�N�ɕ��ނ��ꂽ���҂ɂ����Ă��AMASCC�X�R�A��14.0%�ACISNE�X�R�A��3.1%�Ɏ��S���܂ޏd��ȍ����ǂ��F�߂�ꂽ�B ·
�O�����Ì��ƂȂ銳�҂̑I�ʂɂ́AFN�K�C�h���C����3�łɂĉ��L�̃A���S���Y���i�}1�j����Ă���Ă���B �\2�DMASCC�X�R�A
�\3�DCISNE�X�R�A
�}1�D�O�����Â̌��ƂȂ銳�҂̑I��A���S���Y��
���� 1�j�@���t�|�{ ·
���t�|�{���s���ꍇ�A�����قȂ镔�ʂ���2�Z�b�g�ȏ�i�D�C�{�g��1�{�A���C�{�g��1�{��1�Z�b�g�Ƃ���j���̌����邱�Ƃ�������������B ·
���S�Ö��J�e�[�e���iCVC�j��}���������҂�FN���N�������ꍇ�ACVC�Ɩ����Ö����h�iPV�j��蓯���Ɋe1�Z�b�g�����t�|�{���̎悷�邱�Ƃ�������������BPV����̍̌�������ȏꍇ�ACVC�̈قȂ郋�[��������2�Z�b�g�ȏ�̌��̍̎���s���B ·
����̌��t�|�{���A���������ꍇ�A�R�ۖ^������M����������ꍇ�A��U��M������ɍĔ��M�����ꍇ�A���t�|�{�̍č̌�����������B 2�j�@���t�ȊO�̔|�{���� ·
���t�ȊO�̔|�{�����i�\ႁA�畆���啨�A�A�A�ցA���t�Ȃǁj�́A���ꂼ��̑��튴���ǂ��^���ꍇ�ɓK�X�s���B 3�j�@C�������^���p�N�iCRP�j�A�v���J���V�g�j���iPCT�j ·
�������FN���Ǒ����ɂ͏㏸���Ȃ��ꍇ������A�R�ۖ���J�n���Ȃ������ɂ͂Ȃ�Ȃ��B 4�j�@��-D-�O���J���A�A�X�y���M���X�K���N�g�}���i���R�� ·
FN�̏������Î��ɂ͕K�{�ł͂Ȃ����A�o���I���ÊJ�n3〜4����̍ĕ]�����̌����Ƃ��ďd�v�ł���B ·
�N�P���x�A�X�y���M���X�ǁiIPA�j���^���ꍇ�A�A�X�y���M���X�K���N�g�}���i���R���𑪒肷��B 5�j
�摜�E�������� ·
����X���F�x���f�f�ɑ��鐸�x�͕K�����������Ȃ��B�������A�ȕւȌ����ł���o���I���ÊJ�n���ɂ͎��{����ׂ��ł���B ·
����CT�F�x���̋^���������ꍇ��IPA���^���ꍇ���S�O�������{����B ·
����X���E���������g�����E����CT�F�����Ǐ���ꍇ�ɓK�X�s���B 6�j�@���̑� (��FN�K�C�h���C����3�łŌ��y�̂Ȃ�����) ·
��Ȑf�@�F���͒ቺ�Ȃǂ̐^�ې���������^���ꍇ�Ɏ��{����B ·
�O���B�G�f�F�O���B�����^���ꍇ�Ɏ��{����B ·
CD�g�L�V���F�R�ۖ^���E���^��ŁABristol
Stool Scale 5�ȏ�̉�����24���Ԉȓ���3��ȏ�J��Ԃ��ꍇ�Ɏ��{����B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B.7-2 FN������ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�T�v ·
48���Ԉȓ��ɓK�ȍR�ۖÂ����{����Ȃ��ꍇ�A�咰�۔s���ǂ�30%�A�Δ^�۔s���ǂ�70%�����S����B �������Ái�o���I���Áj 1�j�@���@���� ·
FN�ɑ��鏉�����ÂƂ��čR�Δ^�ۊ�����L�����-���N�^����̒P���Â�������������i�\4�j�B ·
�J���o�y�l���n��̗��p�͌��ɐT�ނׂ��ł���B�������ÂŁi�Z�t�F�s���ł͂Ȃ��A�j�J���o�y�l����I�����邱�Ƃ͗\��Ɗ֘A���Ȃ��Ƃ̌������ʂ�����B�Տ��I�ȏd�Ǔx�⑽�ܑϐ��ہi���Extended-spectrum��-lactamase�iESBL�j�Y���ہj�̕ۋۏ����Ă��A�K���f���ׂ��ł���B ·
�������Â̑�1�I���ɂ̓Z�t�F�s�������������BESBL�Y���ۂ�i�D���������������Ȃǂ́j�ΐ����C���ۂ��֗^����a�Ԃł́A�^�]�o�N�^��/�s�y���V�����܂��̓����y�l���̓��^���l������B ·
��-���N�^����+�A�~�m�O���R�V�h�̕��p�Ö@�́A�����\��̉��P�Ɋ�^�����t�@�\��Q�̍�������������B���̂��߁A�A�~�m�O���R�V�h�̃��[�`���ł̕��p�͐������ꂸ�A���L�̗l�ȏǗ�ɑ��Ă̂ݕ��p����������i�\5�j�B ·
��-���N�^����+�O���R�y�v�`�h�n�R�ۖ�i�o���R�}�C�V���܂��̓e�C�R�v���j���j�̕��p�Ö@�́A�A�~�m�O���R�V�h�Ƃ̕��p�Ö@���G�r�f���X�����Ȃ��B���^�A�i���V�X�ɂă�-���N�^���P�ܗÖ@�ɔ�ׁA�����\��̉��P�Ɋ�^�����t�@�\��Q�̍�������������Ƃ̌��ʂ��łĂ���A���L�̗l�ȏǗ�ɑ��Ă̂ݕ��p����������i�\6�j�B�o���I�ɍRMRSA��p�����ꍇ�A�O�����z���ۂ����o����Ȃ����2〜3���ŕ��p�𒆎~����B ·
���l�]���h����у_�v�g�}�C�V���̕��p�́A�o���R�}�C�V���ϐ������ہiVRE�j�̊������^����Ȃnj��肳�ꂽ�ɂ����Ă̂������ׂ��ł���B ·
G-CSF�̎��ÓI���^���ꗥ�ɂ͍s��Ȃ����Ƃ��キ��������B�d�lj����X�N��L����ꍇ�ɂ�G-CSF�̎g�p���l������B���X�N���q�Ƃ��ẮA66�Έȏ�AFN�̊����A10�����čD������1,000
/��L�������������Ƃ��\���������́A�������R���g���[���s�ǁA�ጌ���A�s���ǂɂ�鑽����s�S�A�[�ݐ��S�؏ǂ�x���Ȃǂ̗Տ��I�Ɋm�F���ꂽ�����ǂ̍����A����������B ·
G-CSF���^�ɔ����L�Q���ۂƂ��āA���ɁA���`�Ǐ�A�}���x��Q/�}���ċz�����nj�Q������B �\4�D�o���I���Âɗp�����ȍR�ۖ�
�\5�D��-���N�^����+�A�~�m�O���R�V�h�̕��p�Ö@�����������
�\6�D��-���N�^����+�O���R�y�v���h�n�R�ۖ�̕��p�Ö@�����������
���V�v���t���L�T�V���A�N�����_�}�C�V���i�������̓A�Y�g���I�i���j�ƂƂ��Ƀo���R�}�C�V���p���� 2)�@�O������ ·
�d�lj����X�N�X�R�A�ɂ����Ē�X�N�ɕ��ނ��ꂽFN���҂ł���A�o���R�ۖ�ɂ��O�����Â��\�ł���i�ア�����j�B�������A��X�N�ɕ��ނ��ꂽFN���҂�9%����ɏd�lj������Ƃ̕�����A�R�ۖ�̏��^��͊O���őS�g��Ԃ���莞�Ԋώ@���A���̌�̊O�����Ò����\���Ȍo�ߊώ@���s���ׂ��ł���B ·
�O�����Â���������ۂɂ́A�@�}�ώ��̐f�Ñ̐��̐����A�A���҂��w���ɏ]���ė��@�ł���A�B���@�ɗv���鎞�ԁA�C�����ҁE���҂̗L���A�D�{�l�̈ӌ��A�Ȃǂ����Ă���B ·
�o���R�ۖÂƂ��Ă̓V�v���t���L�T�V���{�A���L�V�V����/�N���u�����_�̕��p���Â����������B�t���I���L�m�����̒P���Â̓G�r�f���X���s�\���ł���B 3�j
���̑� ·
���𐫐Ö����A�������S�������A�������͌��t�|�{�ɂĉ��F�u�h�E���ہA�Δ^�ہA�o�`���X���A�J���W�_�Ȃǂ̐^�ۂ����o����A�������^����ꍇ�ɂ́A���S�Ö��J�e�[�e���̔����𑬂₩�ɔ������邱�Ƃ�������������BCV�|�[�g�̔����́A���Տ��ł͍���Ȃ��Ƃ������A���X�N�E�x�l�t�B�b�g���l�����Ĕ�������������B ���Ê��ԁA�R�ۖ�̒��~�E�ύX 1�j ���������������肳�ꂽ�ꍇ ·
�R�ۖ�̓��^���Ԃ́A�a���̂Ɗ����a���ɂ�茈�肳���B 2-1�j
���������������肳�ꂸ��M�����ꍇ ·
�������D������ 500 /��L�ɉ���ȑO�ɉ�M�����ꍇ�A�S�g��Ԃ����肵�Ă���R�ۖ�̒��~���\�ł���i�ア�����j�B�������A�R�ۖ�̒��~�E�ύX��̍Ĕ��M�ɑ��Ă͐v���ȑΉ������߂���B 2-2�j�@���������������肳�ꂸ���M�������ꍇ�i�������ÊJ�n��3〜4���ځj ·
FN�i�D����500 /��L�����ł̔��M�j���������Ă���ꍇ�A���t�|�{��Ǐ�ɉ������������s���A��������a���̂̍Đ������s���B ·
�����p�n��ᇂ̂���Ö@��̔��M�ōR�ۖ�A�R�^�ۖ�̎��Â��s���Ă���M���Ȃ��ꍇ�A�T�C�g���K���E�C���X�Ċ������̃X�N���[�j���O���s�����Ƃ��キ��������B���Ƀ����p����������у����p���@�\�}�����d�x�̏ꍇ�ɂ͐��������B ·
�S�g��Ԃ��ǍD�Ŕ��M�ȊO�ɏ������Ȃ��ꍇ�A�R�ۖ�̕ύX�E�lj��͍s�킸�A����R�ۖ���p�����邱�Ƃ͉\�ł���i�ア�����j�B ·
�s���ǐ��V���b�N�Ȃnj��s���Ԃ��s����ȏꍇ�ɂ́A���L��ȃ�-���N�^���n�R�ۖ�ւ̕ύX����������i���������j�B�܂��A��-���N�^���n�R�ۖ�̒����ԓ_�H���^�i4���ԓ��^�j���I�����ƂȂ�i�ア�����j�B���ܑϐ��O�����A�����ۂ̊֗^�̉\��������ꍇ�i�ۋێҁA���ܑϐ��ی��o���������{�݁A�Ȃǁj�̓A�~�m�O���R�V�h�n�R�ۖ�̕��p����������i���������j�B�J�e�[�e���֘A���������ǂ��g�D�����ǂȂǃO�����z�����ۂ̊֗^���^����ꍇ�A�RMRSA��̕��p����������i�ア�����j�B ·
�R����ۊ����̂Ȃ��R�^�ۖ^���ł́A�N�P���A�X�y���M���X�ǂ��x�����A�A�X�y���M���X�K���N�g�}���i���R��������CT�����𑬂₩�ɍs���A�������Áipre-emptive therapy�j�ւƐi�߂�B���������{�ł��Ȃ��ꍇ�A�o���I���Áiempiric therapy�j��D�悳����i���������j�B ���R����ۊ����̂���R�^�ۖ�F�R����ۍ�p�A�]�[���n�R�^�ۖ�A�G�L�m�L�����f�B���n�R�^�ۖ�A�|���G���n�R�^�ۖ� ���R����ۊ����̂Ȃ��R�^�ۖ�F�t���R�i�]�[���Ȃ� ·
�R����ۊ����̂���R�^�ۖ�̓��^���ł́A�������w�I�����Anon-culture based test�i�A�X�y���M���X�K���N�g�}���i���R�������A��-D-�O���J���A�Ȃǁj�A�摜���������{����ƂƂ��ɁA�����ϐ��̂Ȃ��R�^�ۖ�ւ̕ύX�╹�p����������i�ア�����j�B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B.7.3 �R��������̗\�h���^ |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�R�ۖ� ·
7�����čD������100 /��L�������������Ƃ��\�������ꍇ�A�t���I���L�m�����̗\�h���^���������������B�������AFN���ǎ��ɑ��₩�ɏ��u���s����Ƃ������̐��������Ă���ꍇ�A�t���I���L�m�����̗\�h���^�����Ȃ����Ƃ����e�����B ·
�\�h���^����FN�ǂ��A�o�Ö��I�R�ۖ���J�n�����ꍇ�A���̎��_�ŗ\�h���^�Ƃ��Ă̍R�ۖ�͒��~����B ·
�D�����������Ԃ�7�������Ɨ\�������ꍇ�A�R�ۖ�̗\�h���^���ꗥ�ɂ͍s��Ȃ����Ƃ�������������B �j���[���V�X�`�X�x���̗\�h ·
�\�h���^�̖�܂�ST���܂����������B1��1���̘A�����^���W���I�ł��邪�A1��2���̏T2�^�A1��1���̏T3�^�ł��\���ȗ\�h���ʂ�������Ƃ̕�����B ·
ST���܂����^����ȗ�ł́A�A�g�R�o�������������̓y���^�~�W���z�����s�����AST���܂ɔ�ׂė\�h���ʂ͗��B ·
�ȉ��̊��҂ɑ���ST���܂̗\�h���^��������������B �@���푢�����זE�ڐA���銳�� �A�}�������p�������a�A���lT�זE�������a�̊��� �B�v�����A�i���O�Ȃ�T�זE�������������܂̎��Â��銳�� �C���t�玿�X�e���C�h�i�v���h�j�]�������Z��20mg��4�T�Ԉȏ�j�𓊗^����銳�� �D���ː����Âƃe���]���~�h�̕��p���Â��銳�� ·
�ȉ��̊��҂ɑ���ST���܂̗\�h���^���キ��������B �@���c�L�V�}�u���p�Ö@���銳�� �R�^�ۖ� ·
����Ö@�ɂ�鍂�x�ȍD�����������\������銳�ҁi�D�����������}�������a����э����ٌ`���nj�Q�A�S����Q�����Ƒ������זE�ڐA���p�̑�ʂ���Ö@�j�ɑ���\�h���^��������������B ·
�D�����������y�x�ł��鑼�̑������ᇂ�Ō`��ᇂɑ��邪��Ö@�ɂ͐�������Ȃ��B ·
�}�������a�ɑ��ẮA�h�������FLCZ��\�h���^����ꍇ�����邪�A����ۊ������X�N��L���銳�҂ł̓g���A�]�[���n��܁iITCZ�AVRCZ�APSCZ�j��MCFG�̗\�h���^���l������B ·
������ɑ��ẮA�D������100 /��L�����ŏd�ǔS����Q���ꍇ��FLCZ��������MCFG���A�D������100
/��L�����̊��Ԃ�7���Ԃ���ꍇ��VRCZ��������PSCZ�̗\�h���^�����������B �R�w���y�X�E�C���X�� ·
���Ɩ��������זE�ڐA���p�̑�ʂ���Ö@���銳�҂ɑ��āA�P���w���y�X�E�C���X�Ċ�������\�h����ړI�ōR�w���y�X�E�C���X��̗\�h���^��������������B ·
�����E�я��v�]�w���y�X�E�C���X�Ċ�������\�h����ړI�ňȉ��̊��҂ɑ��čR�w���y�X�E�C���X��̗\�h���^��������������B �@ ���Ɩ������čזE�ڐA���p�̑�ʂ���Ö@���銳�� �A �x���_���X�`���̓��^���鈫�������p��� �B �v���e�A�\�[���j�Q��̓��^���鑽����������� ·
�Ō`��ᇂɑ��邪�w�Ö@�ɂ����ẮA�D�����������Ԃ��Z���A�w���y�X�E�C���X�Ċ������̕p�x�����Ȃ����߁A�\�h���^��K�������K�v�Ƃ��Ȃ��B G-CSF ·
�ȉ��̊��҂ɑ��ė\�h���^�����������B �@ FN�̔��Ǖp�x��20%�ȏ�̂���Ö@���s�����ҁi���������j �A FN�̔��Ǖp�x��10〜20%�̂���Ö@���s�����ҁi�ア�����j ·
FN�̔��Ǖp�x��10%�����̂���Ö@���s�����҂ɑ��Ă͗\�h���^�𐄏����Ȃ��B ·
�����Ƃ̃G�r�f���X�ɂ��ẮA���{�����Êw��������Ă���uG-CSF�K���g�p�K�C�h���C���v���Q�Ƃ���B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B.7.4 ����Ö@���銳�҂ɑ��銴���ǃX�N���[�j���O/�T�[�x�C�����X |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B�^�̉� ·
������Â��s���ꍇ�A�S���B�^�̉��̃X�N���[�j���O�iHBs�R���AHBc�R�́AHBs�R�́j���s�����Ƃ�������������BHBc�R�̂܂���HBs�R�����z���̏ꍇ�AHBV-DNA�𑪒肷��B ·
B�^�̉��̊����⎡�Ö�HBV�Ċ������̃��X�N�f���A�j�_�A�i���O�̗\�h���^��HBV-DNA�ʂ̃��j�^�����O���s�����Ƃ�������������B ·
HBV�Ċ��������X�N�͉��L�̒ʂ�ł���B �������ᇁFHBs�R���z����48%�A����������18% �Ō`��ᇁFHBs�R���z����25%�A����������3% ���ڍׂ́A���{�̑��w��@B�^�̉����ÃK�C�h���C���u�Ɖu�}���E���w�Ö@�ɂ�蔭�ǂ���B�^�̉���K�C�h���C���v�̃t���[�`���[�g���Q�Ƃ̂��Ɓi2024�N10�����_�ő�4�Łj�B ���j ·
������Â��s���ꍇ�A���j���҂Ƃ̐ڐG���⌋�j�̊������Ȃǂ̖�f�Ƌ���X���摜�Ȃǂɂ�錋�j�̃X�N���[�j���O���s�����Ƃ�������������B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
B.7.5 ����Ö@����E�Ă��銳�҂ɑ���\�h�ڎ� |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
�я��v�]���N�`�� ·
����Ö@����50�Έȏ�̊��҂ɑ��āA�g�����я��v�]���N�`����2��ڎ���キ��������B �C���t���G���U���N�`�� ·
����Ö@���Ă��銳�҂ɑ���C���t���G���U���N�`���̐ڎ��������������B �x�����ۃ��N�`�� ·
�������ᇂ܂��͌Ō`��ᇂƐf�f���ꂽ���҂ɑ��āA13���܂���15�������^�x�����ۃ��N�`�������23���x������䰖������̃��N�`���̐ڎ���キ��������B |
|||||||||||||||||||||||||||||||||||||||||||||||||||||