脳腫瘍、神経腫瘍
1.診療体制
脳神経外科で取り扱っているがん
脳腫瘍は脳を構成するグリア細胞から発生する原発性脳腫瘍と、肺がんや乳がんなどが脳に転移する転移性脳腫瘍と大きく2つに分けられます。
原発性脳腫瘍の分類では、世界保健機関(World Health Organization:WHO)の脳腫瘍分類(Classification of Tumours of the Central Nervous System)があり、1979年に初版が発行されて以来、診断技術の進歩に合わせて改訂を重ね、今回、2016年に第4版の改訂版(WHO2016)が発行されました。原発性脳腫瘍は悪性度がグレードⅠからグレードⅣまでに分類されています。良性腫瘍のほとんどはグレードⅠであり、悪性脳腫瘍はグレードⅡ〜Ⅳに分類されます。悪性脳腫瘍の治療としては、手足の動きや言語などの機能を温存して手術で可能な限り摘出し、放射線治療や化学療法を行います。悪性脳腫瘍の代表的なものは、神経膠腫や中枢神経系悪性リンパ腫です。子どもに多い胚細胞腫瘍や髄芽腫はグレードⅣの悪性脳腫瘍ですが、放射線治療と化学療法でしっかりと治療することによって、治癒(寛解)することが期待できます。神経膠腫は大きく星細胞腫と乏突起膠腫に分けられます。星細胞腫や乏突起膠腫はグレードⅡで、これが悪性化してグレードⅢになったものが退形成性星細胞腫・退形成性乏突起膠腫です。最も悪性度の高い脳腫瘍はグレードⅣの膠芽腫です。
鹿児島大学脳神経外科では、2015年の脳腫瘍の手術件数は246例で全国3位となっており、その中で神経膠腫の手術件数も61例で全国3位となっています。全国屈指の症例数を誇り、手術のみならず臨床研究や治験に積極的に参加し最先端の脳腫瘍治療を行っています。
2.診断
脳神経外科における診断体制
| 1.CT(コンピュータ断層撮影)、 MRI(核磁気共鳴像) |
現在の画像診断の中心をなす検査法です。腫瘍の位置や大きさが分かり、造影剤を使用することで脳腫瘍の画像上の特徴がわかります。 |
|---|---|
| 2.PET検査(陽電子放射断層撮影) | PET検査は放射線を出す特殊な薬剤を注射し、その薬剤が腫瘍内に取り込まれ、薬剤が発する放射線を特殊なカメラを使って外部から検出し画像化します。薬剤の取り込みの程度により良悪性の鑑別診断が可能であり、また治療の効果判定や残存腫瘍診断、再発診断も可能です。 |
| 3.脳血管造影検査 | 脳の血管を造影することにより、腫瘍への栄養血管や腫瘍自体の血管の性状などの詳細な情報が得られ、診断や手術計画に用いる重要な検査です。 |
上記の画像検査を総合的に判断し術前診断を行っています。鹿児島大学脳神経外科では毎週、放射線科と合同カンファレンスを行い、より正確な術前診断を行っています。その術前診断に基づき、綿密な手術計画を立て、より確実でより安全な手術を行っています。
3.治療
脳神経外科で取り扱う治療(手術・集学的治療等)
最新の手術支援装置を駆使して行われる神経膠腫摘出手術をご紹介します。
神経膠腫は脳を構成するグリア細胞から発生する腫瘍です。MRI等の画像上では脳と腫瘍の境界がありますが、細胞レベルで見ると正常な脳を構成する細胞と腫瘍細胞は境界領域で混ざり合っており、境界は不明瞭になっています。特に悪性度が高くなるほど、この傾向が強くなり、腫瘍細胞の混ざり込む領域が広くなります。よって様々な情報を用いて摘出すべき腫瘍細胞の多い領域と残すべき領域を峻別し、摘出範囲を決定していかなければなりません。脳腫瘍の中でも悪性神経膠腫は未だに治療困難な腫瘍であり、特に最悪性の膠芽腫はヒトに発生する悪性新生物の中でも最も予後の悪い腫瘍です。とはいえ、脳神経外科領域における集学的治療は徐々に進歩しており、手術手技や手術支援装置も大きく進歩しています。ここでは鹿児島大学脳神経外科における手術支援システムをご紹介し、摘出率の向上を目指しながら機能温存を図る最新の神経膠腫の手術の進歩を供覧します。
ニューロナビゲーションシステム
ニューロナビゲーション(図1a)は、術前に撮影されたMRIやCT画像から3次元画像をコンピュータ上に再現し、実際の手術時の頭蓋や脳の位置と画像情報を一致させることにより、手術操作を行っている部分をコンピュータ上で特定するシステムです(図1b:赤の十字が到達している部分を示します)。現在ほとんどの全ての神経膠腫の手術で使用されています。このニューロナビゲーションにより腫瘍の位置や広がりを正確に把握できるようになりました。また、このシステムでは基本画像に様々な情報を融合させる事ができます。代謝情報を元に腫瘍の悪性度や広がりを示すPET検査の結果や、脳内の神経線維の走行を示すトラクトグラフィ(図2a)の情報を融合させ、3次元的に確認しながら腫瘍摘出を行う事で、悪性度の高いところを取り残したり、重要な神経線維を傷つけたりすることを防ぐことができるようになりました。
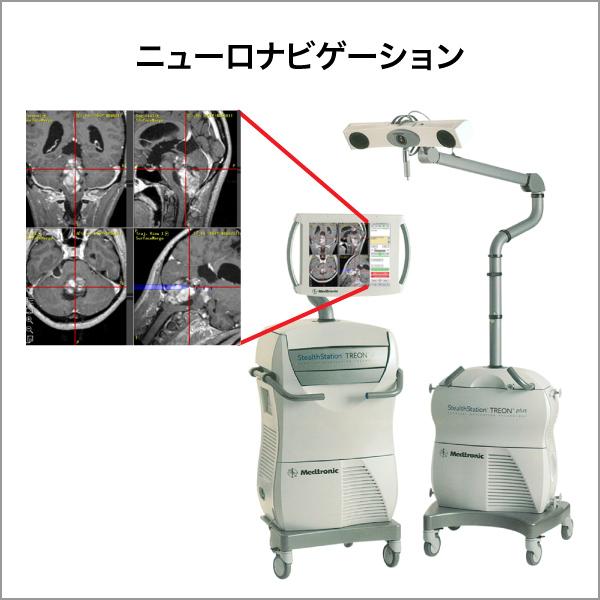
図1a ニューロナビゲーション
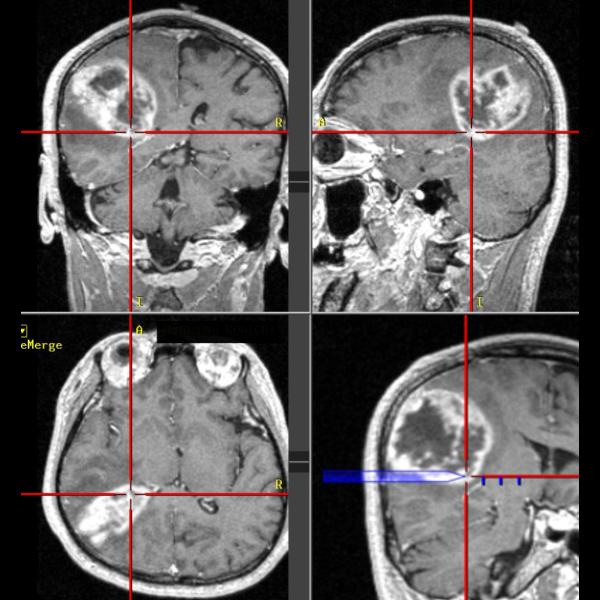
図1b
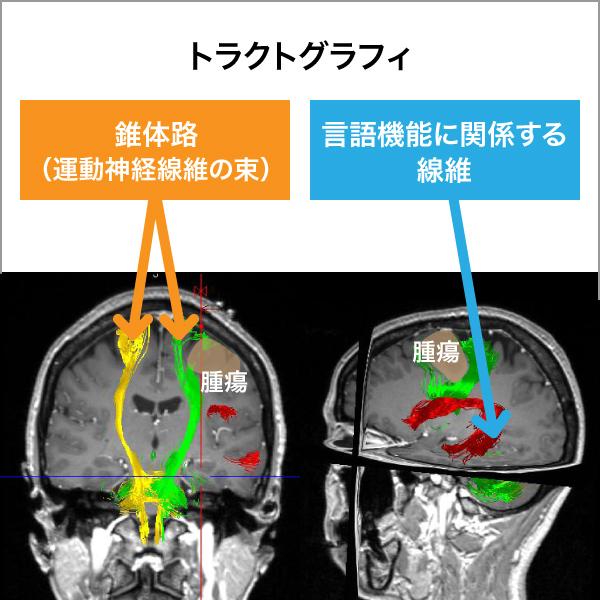
図2a トラクトグラフィ
電気生理学的検査システム
手術中に脳を電気刺激することにより、重要な運動機能の在りかを確認することができます。この電気生理学的支援では、従来の大脳皮質刺激に加えて大脳白質線維刺激による検査も可能になっています。図2aのトラクトグラフィをナビゲーションに取り込むと、手術中に問題となる錐体路が近くに来た時、直接刺激し(図2b)、重要な神経線維の存在部位を直接確認することができます(図2cは脳を刺激した時の手の筋肉の反応です)。術後の麻痺を回避でき、脳外科手術の安全性は大きく向上しました。このような電気生理学的な手術支援は、覚醒下手術における言語機能保存にも力を発揮し、神経膠腫以外でも顔面神経や聴神経の手術、脳幹部の手術で頻用される技術となっています。
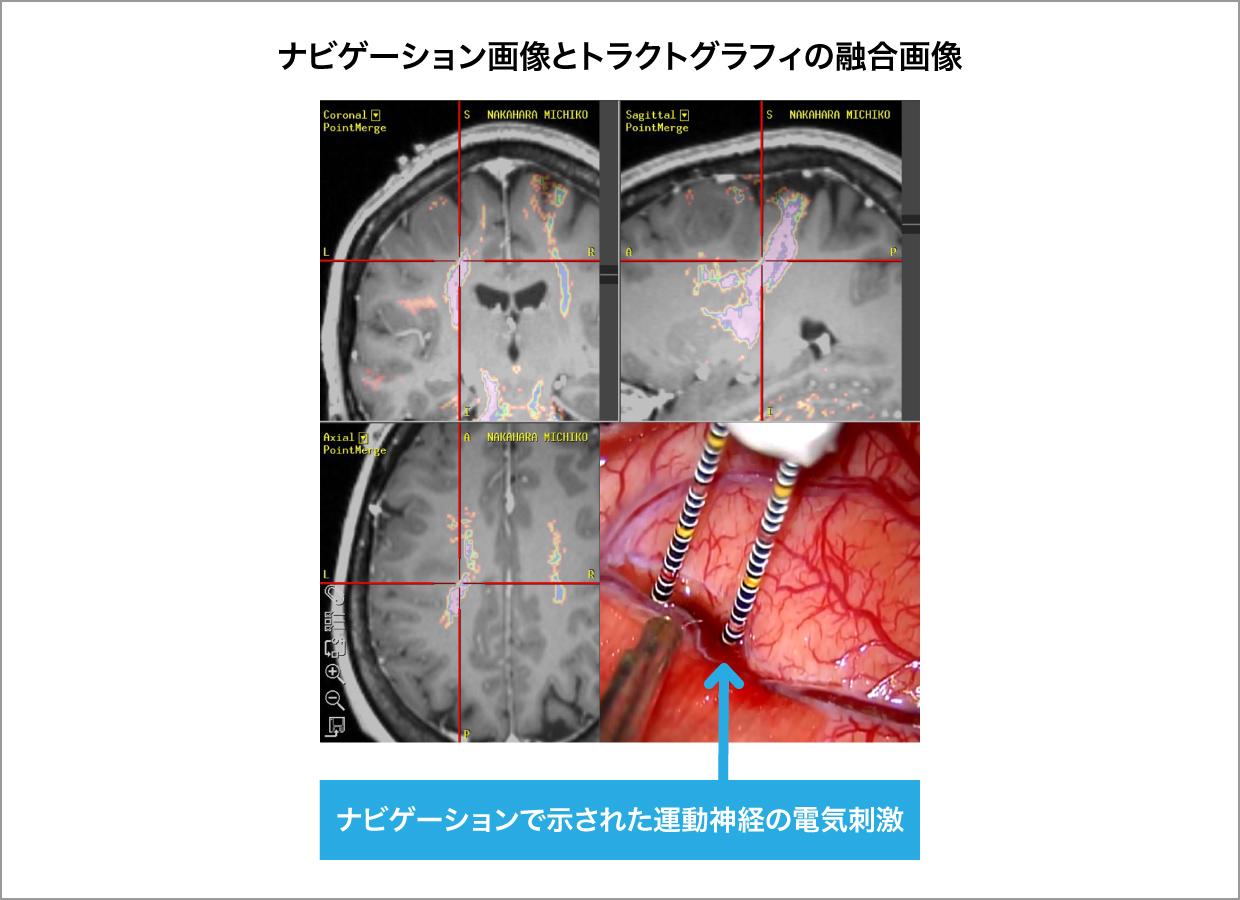
図2b
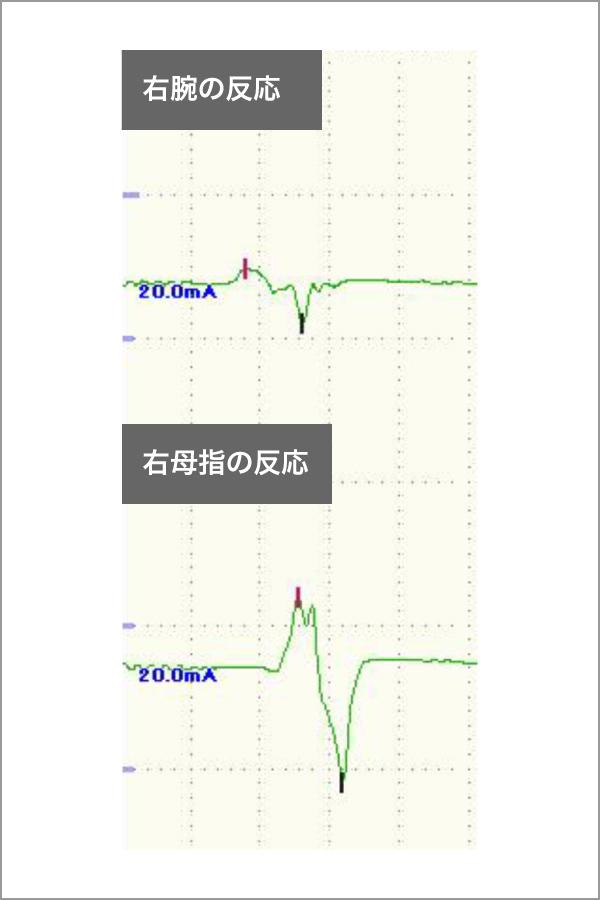
図2c
蛍光観察下手術
悪性度の高い脳腫瘍を手術中に光らせて確認する蛍光観察下手術も悪性神経膠腫の手術支援として利用されています。これは5-アミノレブリン酸(5-ALA)という薬を術前に内服すると体内でプロトポルフィリンに変化し、これが悪性腫瘍に集積することを利用しています。手術中に特殊な光を照射すると腫瘍に含まれるプロトポルフィリンがピンクの蛍光(図3)を発するため、境界の分かりにくい悪性腫瘍でもその存在が明らかになり、取り残しを防ぐことができます。
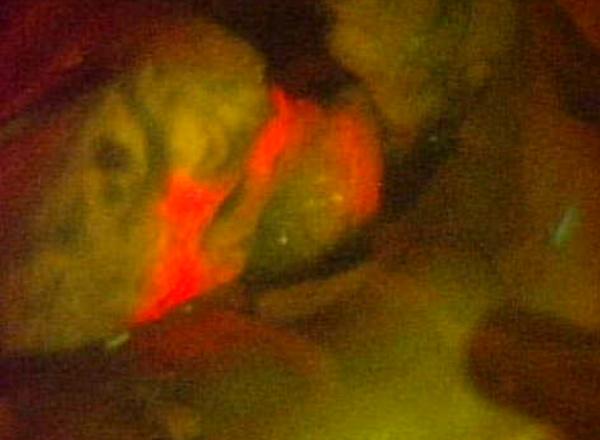
図3
術中MRI
脳は軟かい組織で、脳脊髄液の中に浮いています。手術中に脳脊髄液が吸引排出されると徐々に脳は変形していきます。よって術前に撮影した画像を利用したニューロナビゲーションの情報は手術の進行とともに実際とはずれてしまうことが問題になります。そこで手術中にMRIを撮影して、新しい画像情報を得るようにするのが術中MRIです。鹿児島大学病院は2009年10月より術中MRI(0.3T Hitachi AIRIS plus)が稼働しはじめました(図4a:手術室内MRIでの撮影風景)。手術途中でMRIを撮影することで残存腫瘍の確認が可能になり、摘出率の向上に大きく寄与するとともに、摘出しすぎによる術後の機能障害を防ぐことにも役立っています。さらに、術中MRIにより、手術中に予測しなかった術野以外の脳内出血などのアクシデントにも閉頭前に対応できますから、安全面への貢献も期待されます。図4bは図1bの腫瘍を摘出した後にMRIを撮影し、その画像を改めてニューロナビゲーションに取り込んだところです。脳が変形していますが、白く造影されていた腫瘍がほぼ摘出されていることが分かります。
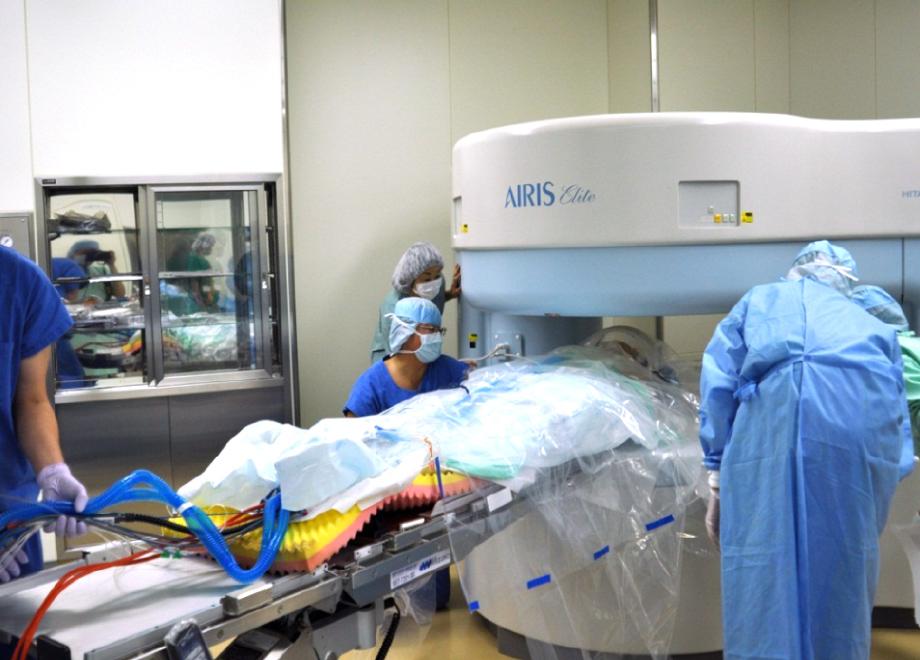
図4a
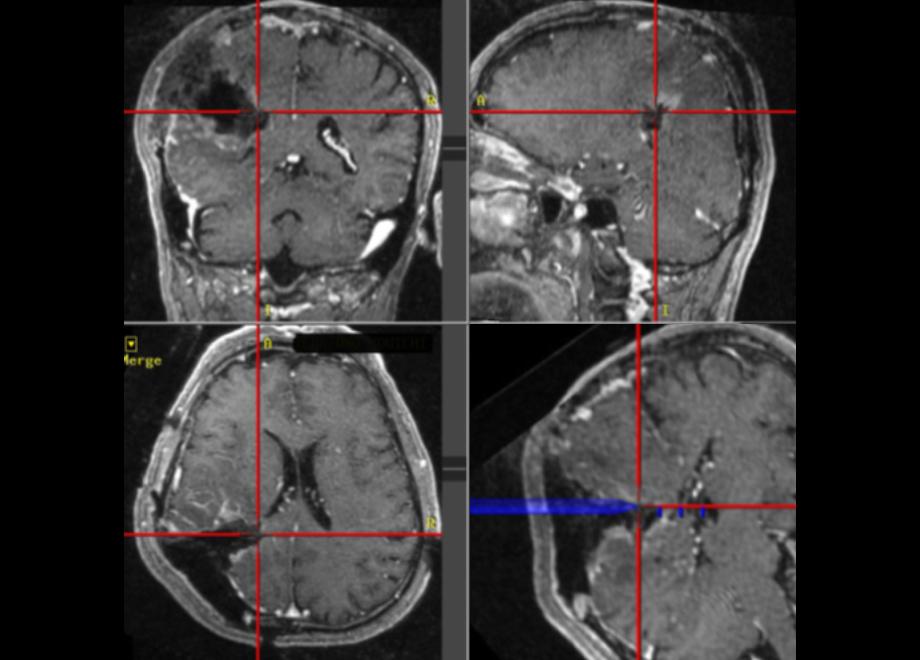
図4b
実際の症例
| 左側頭葉の膠芽腫 | 80歳代。言語障害、記銘力障害で発症しました。 |
|---|
1
左側頭葉に造影される部分が2カ所認められる膠芽腫です(図5-1)。周辺部に脳浮腫(やや黒い部分)を伴っています。左側頭葉の上側頭回には言語中枢(ウェルニッケ野)があり、ここを避けて摘出を行う必要があります。 青の線はシルビウス裂(前頭葉と側頭葉の境界)です。
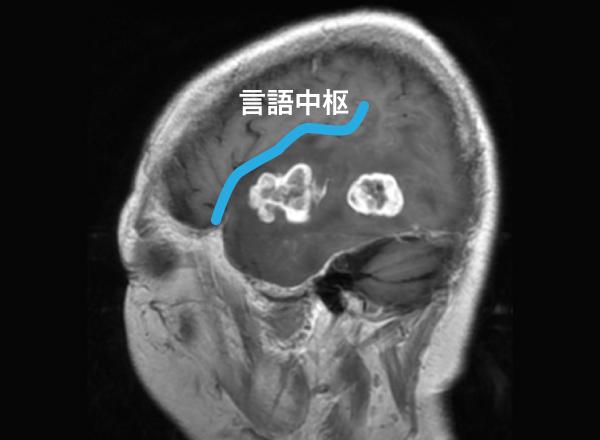
図5-1
2
図5-2に左側頭部の開頭のための皮膚切開(赤)と骨開頭(青)を示します。図5-3は骨を除去し、硬膜を切開したところです。一見したところ腫瘍は表面上は見えていません。(脳の表面に黒糸を置いて目印を描いています。)
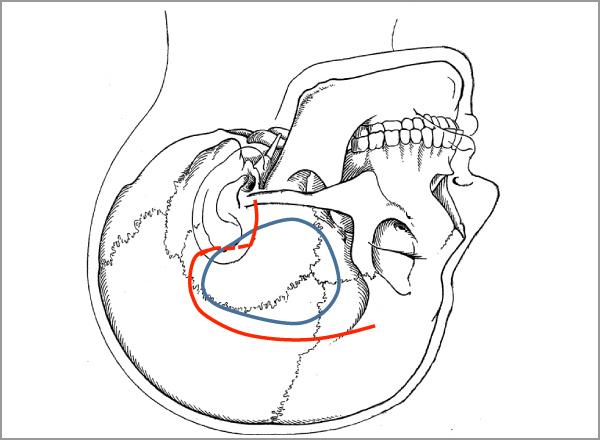
図5-2
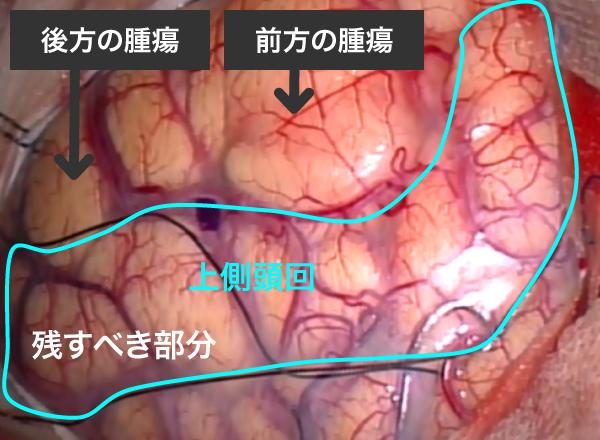
図5-3
3
腫瘍は脳の中に存在し、脳表からは少し腫れている程度にしか見えませんが、ニューロナビゲーションを使うと、どこに腫瘍が埋まっているか分かります。不必要に脳を切り開くことなく、1 mmから1.5mmの精度で腫瘍に到達できます。今回は言語中枢がある上側頭回の後方を保存するように手術を行います。
4
腫瘍と上側頭回の間を切離しています(図5-4)。ある程度切除した後に蛍光観察すると図5-5に示すようにピンクに光る悪性部分(青線で囲った部分)が確認出来ます。
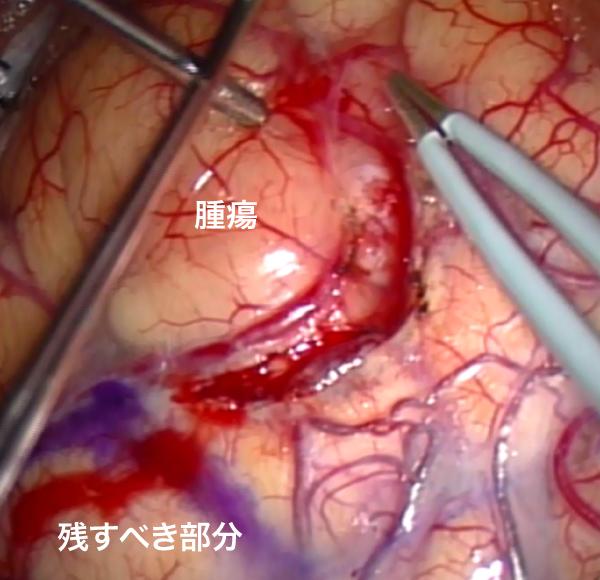
図5-4
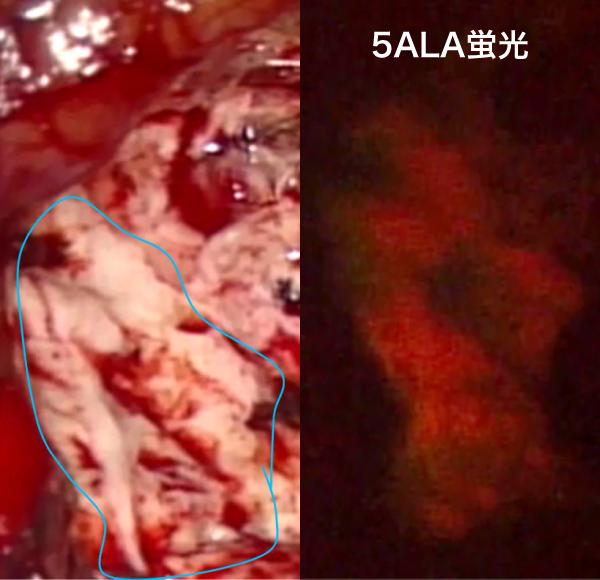
図5-5
5
腫瘍が摘出された段階で、MRIを撮影しました。術中MRIの画像で造影される部分が残っていないか確認します。撮影した画像をニューロナビゲーションに入れて、細かく観察しています(図5-6)。既に造影効果を持つ腫瘍は全摘されていることが確認されました。
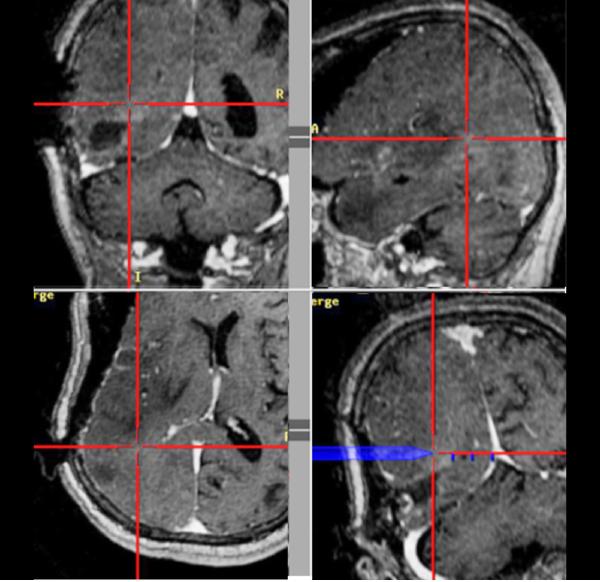
図5-6
6
もし残存腫瘍が確認されれば、更新されたデータによるニューロナビゲーションを頼りに、さらに腫瘍摘出を行い、全摘を目指します。
7
手術後1月経過したときのMRI(図5-7)です。造影される腫瘍塊は消失し、脳の腫れも見られません。
8
言語中枢に近いところでは覚醒下手術を行うこともあります。今回はご高齢で手術中覚醒が困難なため通常麻酔の手術でしたが、失語症は回避できました。最近では高齢でも神経膠腫の手術を行うことが可能です。
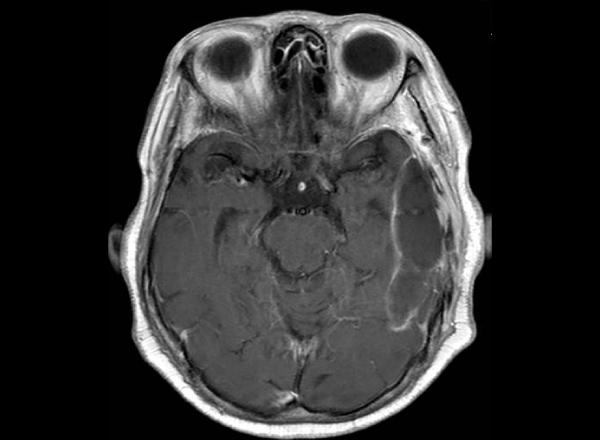
図5-7
4.薬物治療
脳神経外科で取り扱う治療(薬物治療)
神経膠腫の治療は手術だけでは終了になりません。それは、腫瘍が浸潤性で、手術で大部分の腫瘍細胞が摘出されたとしても、周囲の組織に腫瘍細胞が残るためです。そのため、術後には放射線や抗がん剤(テモゾロミド)の投与が必要になります。また、分子標的薬であるベバシズマブが使用されるようになっています。ベバシズマブはVEGFという腫瘍血管内皮細胞増殖因子を阻害することで血管新生を抑えたり腫瘍の増殖を抑えたりします。膠芽腫の場合、手術後の治療を行わなければ、画像上の全摘が得られていても数ヶ月で再発します。最近は手術の進歩のみならず、放射線治療や抗がん剤の効果も改善されてきました。また、副作用も従来の抗がん剤に比べると軽くなっていますので、高齢でも手術、放射線治療、抗がん剤の使用が可能な場合が十分あります。継続した外来での治療と検査が重要です。
鹿児島大学脳神経外科では、術後の治療にも力を入れており、ソーシャルワーカーの協力も得ながら、手術だけでなく長期的な診療態勢の充実を図っています。
5.腫瘍治療電場療法
腫瘍治療電場療法とはどのような治療?
1. 腫瘍治療電場療法による治療をいつ始めるのか?
初発膠芽腫の場合、可能な限り手術で腫瘍を摘出、術後にテモゾロミドを併用する放射線治療、その後テモゾロミドによる維持化学療法、という標準治療が確立されています。腫瘍治療電場療法はこのテモゾロミドによる維持化学療法を開始するタイミングで始めます。2017年12月、一定の基準を満たす医療機関において保険による治療が適用となりました。
再発膠芽腫の場合、可能であれば手術や放射線療法、化学療法などを行い、その後腫瘍治療電場療法による治療を開始します。ただし保険適用外で、自由診療となっています。
2. どこで腫瘍治療電場療法が受けられる?
一定の基準を満たす医療機関において腫瘍治療電場療法が受けられます。当院で治療可能です。
3. 腫瘍治療電場療法はどのような治療?
アレイと呼ばれる電極パッド4枚を、頭髪をきれいに剃った頭皮に貼ります。

アレイと本体を接続し、アレイを介して脳内の腫瘍細胞へ電場を印加することによって、腫瘍細胞の分裂を遅延または停止を促す治療法です。
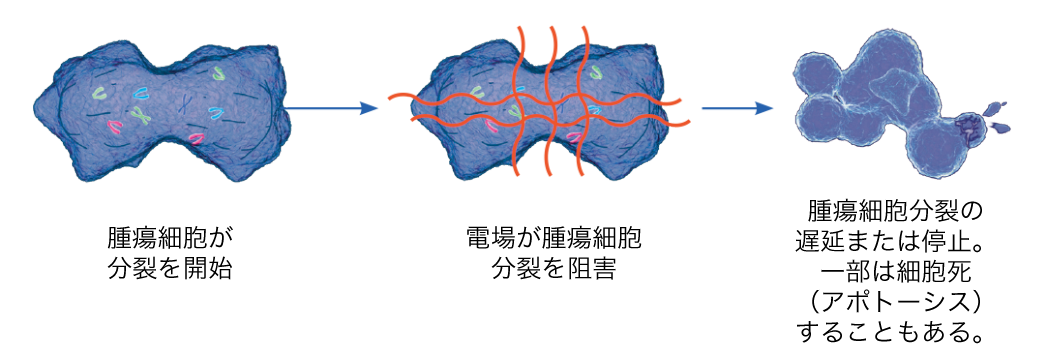
薬と違って電源が入っている間しか治療効果がないので、可能な限りの継続的治療が推奨されます(1日平均18時間以上の使用が目安です)。
頭髪が伸びるとアレイと頭皮の間に空間ができ、それが抵抗となってアレイが正しく機能しなくなるため、アレイ交換の度に頭髪をていねいに剃って、交換する必要があります。個人差がありますが、週2回程度交換します。ひとりでアレイを交換するのは難しいので、家族や友人、訪問看護師等のサポートが必要です。治療の概要についてはこちらのビデオを参考にしてください。
4. 治療中のサポート体制は?
デバイス・サポート・スペシャリスト(DSS)が24時間体制でサポートします。DSSは機器に関する質問に答えたり、何時間治療を行ったか機器に記録されるログを見て、その情報を主治医に提供したりします。
5. 治療を行いながら日常生活を送るには?
治療は自宅で行います。治療しながら日々の仕事や家事を行い、外出や旅行など楽しむことができます。
治療の際は頭髪を丁寧に剃ってアレイと呼ばれる電極パッドを貼りますが、ウィッグ(かつら)や帽子などを着用することが可能です。
アレイを貼付したまま飛行機へ搭乗して移動することができますので、旅行などに行くこともできます。
注意が必要な有害事象
海外で実施された臨床試験で腫瘍治療電場療法がテモゾロミドの副作用を増大する事実はありませんでした。化学療法は薬剤が血流を通して全身に行き渡るため、全身の正常細胞に影響を及ぼしえますが、腫瘍治療電場療法は腫瘍を標的とした局所療法で、脳や全身の正常細胞に影響を与えません。

腫瘍を標的とした局所療法で、脳や全身の正常細胞に影響を与えません。
化学療法などの薬剤が血流を通して全身に行き渡るため、全身の正常細胞に影響を及ぼしえます。
腫瘍治療電場療法の主な副作用は、アレイの貼付箇所の皮膚炎症です。臨床試験では、約半数に皮膚障害があったことが報告されましたが、症状はいずれも軽度から中等度のもので、局所的な対応や治療を一時的に中断することで対処できました。
画像・動画提供:ノボキュア株式会社 https://www.novocure.co.jp/
先進医療、臨床研究、治験
脳神経外科でおこなっている高度医療、最新の治療、研究等
手術法や検査機器、化学療法、放射線治療の進歩により神経膠腫の成績は改善してきましたが、特に悪性度の高いグレードⅣの生存率は低いままです。またグレードⅡやⅢであっても悪性化して再発した場合は治療の選択肢が限られ、治療の難しいところです。これらを少しでも改善するためには、新規治療法の開拓が必要になります。鹿児島大学脳神経外科では、新規治療法開拓のための臨床研究及び治験に積極的に参加しています。鹿児島大学脳神経外科が参加している臨床研究及び治験を以下に紹介します。
臨床研究
| 1.JCOG:1114(先進医療) | 初発中枢神経系原発悪性リンパ腫に対する照射前大量メトトレキサート療法+放射線治療と照射前大量メトトレキサート 療法+テモゾロミド併用放射線治療+テモゾロミド維持療法とのランダム化比較試験 |
|---|---|
| 2.JCNSGCTSG | 初発の頭蓋内原発胚細胞腫に対する放射線・化学療法第Ⅱ相臨床試験 |
| 3.JCOG:1016 | 初発退形成性神経膠腫に対する術後塩酸ニムスチン(ACNU)化学放射線療法先行再発時テモゾロミド化学療法をテモゾ ロミド化学放射線療法と比較するランダム化第Ⅲ相試験 |
| 4.JCOG:1303 | 手術後残存腫瘍のあるWHO Grade Ⅱ星細胞腫に対する放射線単独治療とテモゾロミド併用放射線療法を比較するランダム化第Ⅲ相試験 |
| 5.BIOMARK | 初発膠芽腫に対する放射線療法併用テモゾロミド、ベバシズマブ療法および増悪または再発後のベバシズマブ継続投与の有効性と安全性を検討する第Ⅱ相臨床試験 |
| 6.JCOG:1308C(先進医療) | 再発膠芽腫に対する用量強化テモゾロミド+ベバシズマブ逐次併用療法をベバシズマブ療法と比較する多施設共同ランダム化第Ⅲ相試験 |
| 7.RADICAL試験 | 初発膠芽腫に対するカルムスチン脳内留置用剤および放射線療法併用テモゾロミド、ベバシズマブ療法の有効性・安全性を検討する第Ⅱ相臨床試験 |
治験
| 1.ONO-4538-36 | 初発のMGMT(腫瘍内O-6-メチルグアニンDNAメチルトランスフェラーゼ)非メチル化成人膠芽腫患者を対象に、 放射線療法をそれぞれ併用し、ニボルマブとテモゾロミドを比較する無作為化第Ⅱ相単盲検試験 |
|---|---|
| 2.ONO-4538-40 | 初発のMGMT(腫瘍内O-6-メチルグアニンDNAメチルトランスフェラーゼ)メチル化成人膠芽腫患者を対象に、 テモゾロミド及び放射線療法とニボルマブ又はプラセボを併用する無作為化第Ⅱ相単盲検試験 |
| 3.ONO-4059 | 再発又は難治性の中枢神経系原発リンパ腫(PCNSL)に対する多施設共同非盲検非対照試験 |
| 4.DSP-7888 | 初発期治療後に再発又は増悪した膠芽腫患者を対象としたDSP-7888投与エマルションとベマシズマブ併用対ベバシズマブ単独の多施設共同ランダム化第2相試験 |

