臨床研究部門(利益相反審査委員会)
▶治験審査委員会(治験管理部門)
▶トップページ
▶トップページ
▶関連規則
▶利益相反審査委員
▶鹿児島大学病院における臨床研究に係る利益相反管理について
▶利益相反審査申請様式(自己申告書)
▶利益相反自己申告書の提出手順(臨床研究)
▶利益相反自己申告書の提出手順(治験:製造販売後臨床試験)
▶各委員会に関するお問合わせ
委員長ご挨拶
ヒトを対象とした医学研究を産学連携で実施する場合には、医学研究の対象として健常人、患者などの参加が不可欠です。したがって、医学研究に携わる者には研究者として資金及び利益提供者である製薬企業などに対する義務を負うとともに、被験者の生命の安全、人権擁護をはかる職業上の義務を負います。一人の研究者におけるこのような二つの義務は時に相反し、対立しますが、このような義務の衝突、利害関係の対立・抵触関係がいわゆる利益相反(Conflict of Interest:COI)とよばれる状態です。
医学研究者としての義務と医療専門家である医師としての義務が対立した場合、医療専門職にある研究者が被験者の人権擁護を最優先し、被験者の利益のために最善を尽くすのは当然です。したがって、資金提供者の利益のために、あるいは自分の利益のために研究方法、データ解析、結果の解釈を歪めることは絶対にあってはならないことであり、社会的にも許されない行為です。
この度、鹿児島大学病院 臨床研究倫理委員会・治験審査委員会に申請される臨床研究はすべて利益相反審査委員会の審査を受けることになりました。医学研究者の使命は医学研究によって難病とされる疾患の診断、治療、予防法などを開発し、できるだけ早くベッドサイドに届けることですが、このような研究には企業との産学連携が欠かせません。COI開示は社会からの疑義や不信を除くとともに、自らの行為が公明公正であることを示すために研究者が自発的に行うものです。そして、組織として各研究者のCOI状態を適切に把握してマネージメントすることは透明性、公明性をもって産学連携を推進し、医学研究を適正に発展させるために必要なことです。
COI開示は産学連携活動を規制したり、個人への正当な報酬などを減じるためのものではありません。医学研究者がCOIを自己開示し、鹿児島大学病院において実施される臨床研究が適切な審査を経て、透明性、正当性および客観性が確保されたうえで実施されるようご協力をお願いします。
委員長 西尾 善彦
申請を希望する研究者へのお知らせ
鹿児島大学病院における臨床研究倫理委員会・治験審査委員会に申請する研究はすべて利益相反審査委員会において審査を受け、承認を得る必要があります。
平成27年1月以降審査分の各委員会への申請を行う臨床研究(治験及び製造販売後臨床研究を含む)実施者等は、「利益相反自己申告書」の提出が必要となります。
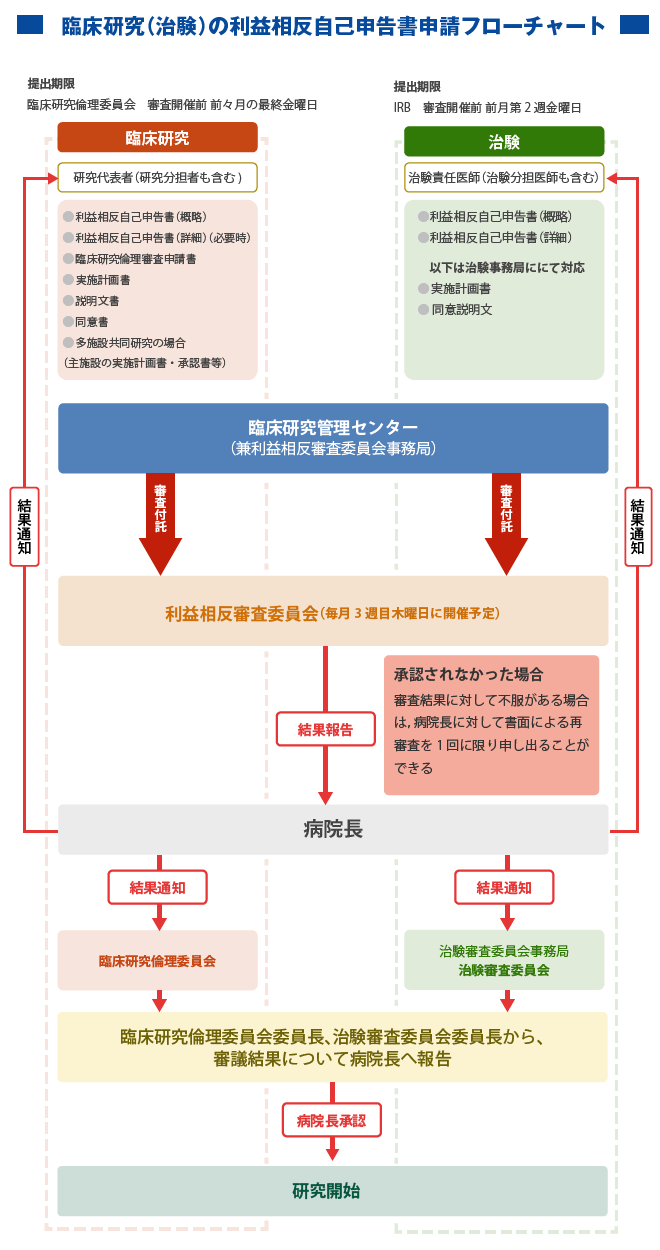
臨床研究の利益相反自己申告書申請のフローチャートは下記のとおりです。

 HOME
HOME 病院紹介
病院紹介 受診される方へ
受診される方へ 医療関係者の方へ
医療関係者の方へ 診療科案内
診療科案内 部門案内
部門案内 よくある質問
よくある質問 お問合せ
お問合せ アクセス・駐車場
アクセス・駐車場


