臨床研究管理センターとは
治験審査委員会に関するご案内はこちら
臨床研究を始める前に
人を対象とする生命科学・医学系研究に関する倫理指針関連
臨床研究法関連
鹿児島大学臨床研究審査委員会は厚生労働大臣より認定されました
旧CRB(認定番号:CRB7180011)
▶(旧CRB)認定臨床研究審査委員会申請・情報公開システムに公開されている詳細情報はこちら
現行CRB(認定番号:CRB7210001)
▶(現行CRB)認定臨床研究審査委員会申請・情報公開システムに公開されている詳細情報はこちら
・認定年月日:西暦2021年7月2日
臨床研究法の規制を受ける特定臨床研究とは
平成30年4月1日より「臨床研究法」が施行されます
臨床研究法において、臨床研究とは「医薬品等を人に対して用いることにより、当該医薬品等の有効性又は 安全性を明らかにする研究」と定められています。特定臨床研究とは、臨床研究のうち以下の2つのいずれかに 該当する研究を指します。
▶医薬品製造販売業者等から研究資金の提供を受けて実施する臨床研究
▶医薬品医療機器等法において「未承認」あるいは「適応外」の医薬品等※を用いて行われる臨床研究
※ 医薬品等・・・医薬品、医療機器、再生医療等製品が含まれます。
※ 治験及びいわゆる観察研究は特定臨床研究には該当しません。
鹿児島大学臨床研究審査委員会の運営規則等
運営規則等
審査手数料
| 区分 | 審査手数料1 件当たり |
| 新規審査手数料(疾病等報告含む。) | 500,000円 |
| 継続審査(各種報告を含む。) | 200,000円 |
公開情報
| 審査委員会(認定番号:CRB7180011) | 開催日 | 議事要旨 |
| 2018年度第1回 | 2019年2月4日(月) | |
| 2018年度第2回 | 2019年3月4日(月) | |
| 2019年度第1回 | 2019年4月1日(月) | |
| 2019年度第2回 | 2019年5月13日(月) | |
| 2019年度第3回 | 2019年8月5日(月) | |
| 2019年度第4回 | 2019年11月11日(月) | |
| 2019年度第5回 | 2019年12月2日(月) | |
| 2019年度第6回 | 2020年1月6日(月) | |
| 2019年度第7回 | 2020年2月3日(月) | |
| 2019年度第8回 | 2020年3月2日(月) | |
| 2020年度第1回 | 2020年4月6日(月) | |
| 2020年度第2回 | 2020年5月11日(月) | |
| 2020年度第3回 | 2020年6月1日(月) | |
| 2020年度第4回 | 2020年7月6日(月) | |
| 2020年度第5回 | 2020年8月3日(月) | |
| 2020年度第6回 | 2020年9月7日(月) | |
| 2020年度第7回 | 2020年10月5日(月) | |
| 2020年度第8回 | 2020年11月2日(月) | |
| 2020年度第9回 | 2020年12月7日(月) | |
| 2020年度第10回 | 2021年1月4日(月) | |
| 2020年度第11回 | 2021年2月1日(月) | |
| 2020年度第12回 | 2021年3月1日(月) | |
| 2021年度第1回 | 2021年4月5日(月) | |
| 2021年度第2回 | 2021年5月10日(月) | |
| 2021年度第3回 | 2021年8月2日(月) |
| 審査委員会(認定番号:CRB7210001) | 開催日 | 議事要旨 |
| 2021年度第1回 | 2021年10月4日(月) | |
| 2021年度第2回 | 2022年1月17日(月) | |
| 2021年度第3回 | 2022年2月7日(月) | |
| 2021年度第4回 | 2022年2月14日(月) | |
| 2021年度第5回 | 2022年3月7日(月) | |
| 2022年度第1回 | 2022年4月4日(月) | |
| 2022年度第2回 | 2022年4月11日(月) | |
| 2022年度第3回 | 2022年4月25日(月) | |
| 2022年度第4回 | 2022年5月2日(月) | |
| 2022年度第5回 | 2022年5月18日(水) | |
| 2022年度第6回 | 2022年5月23日(月) | |
| 2022年度第7回 | 2022年5月30日(月) | |
| 2022年度第8回 | 2022年6月6日(月) | |
| 2022年度第9回 | 2022年7月4日(月) | |
| 2022年度第10回 | 2022年8月4日(月) | |
| 2022年度第11回 | 2022年9月5日(月) | |
| 2022年度第12回 | 2022年10月3日(月) | |
| 2022年度第13回 | 2022年11月7日(月) | |
| 2022年度第14回 | 2023年2月6日(月) | |
| 2023年度第1回 | 2023年4月3日(月) | |
| 2023年度第2回 | 2023年5月1日(月) | |
| 2023年度第3回 | 2023年6月5日(月) | |
| 2023年度第4回 | 2023年7月3日(月) | |
| 2023年度第5回 | 2023年9月4日(月) | |
| 2023年度第6回 | 2023年10月2日(月) | |
| 2023年度第7回 | 2023年11月6日(月) | |
| 2023年度第8回 | 2024年1月15日(月) | |
| 2023年度第9回 | 2024年3月4日(月) | |
| 2024年度第1回 | 2024年4月1日(月) | |
| 2024年度第2回 | 2024年5月13日(月) | |
| 2024年度第3回 | 2024年6月3日(月) | |
| 2024年度第4回 | 2024年7月1日(月) | |
| 2024年度第5回 | 2024年8月5日(月) | |
| 2024年度第6回 | 2024年9月2日(月) | |
| 2024年度第7回 | 2024年10月7日(月) | |
| 2024年度第8回 | 2024年12月2日(月) | |
| 2024年度第9回 | 2025年1月6日(月) | |
| 2024年度第10回 | 2025年2月4日(火) | |
| 2024年度第11回 | 2025年3月3日(月) | |
| 2025年度第1回 | 2025年4月7日(月) | |
| 2025年度第2回 | 2025年5月12日(月) | |
| 2025年度第3回 | 2025年7月7日(月) | |
| 2025年度第4回 | 2025年8月4日(月) | |
| 2025年度第5回 | 2025年10月6日(月) |
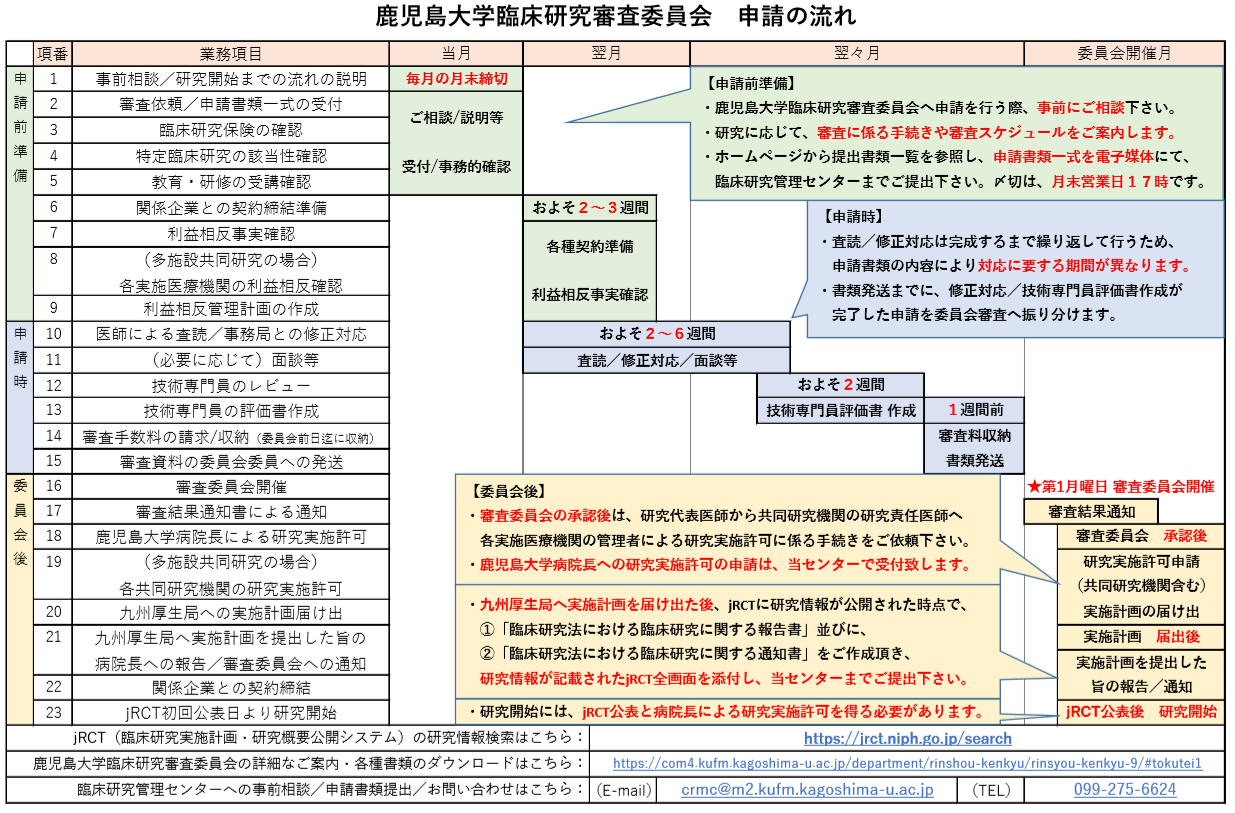
特定臨床研究 申請の流れ
▶認定臨床研究審査委員会へ新規臨床研究の審査を申請する場合の流れについて説明します。
▶認定臨床研究審査委員会は原則月に1回開催されます。
▶特定臨床研究の各種書類の修正対応及び技術専門員評価が完了し、審査可能となった研究のみ委員会審査に振り分けます。
鹿児島大学臨床研究審査委員会の開催日程と書類締め切り日
| □下記の画像はこちらよりPDFダウンロード可能です。 |
臨床研究法の統一書式
統一書式とは
臨床研究法(平成29年法律第16号)に基づいて実施する臨床研究において、統括管理者、研究責任医師及び認定臨床研究審査委員会が審査意見業務に対応する場合に、省令様式及び通知書式と併せて用いる推奨書式である。
参考
臨床研究法の統一書式について(令和7年5月15日厚生労働省医政局研究開発政策課事務連絡)
臨床研究法の統一書式一覧
| 番号 | 資料名 | DL |
| 書式1 | 研究分担医師リスト | WORD |
| 書式2 | 新規審査依頼書 | WORD |
| 書式3 | 変更審査依頼書 | WORD |
| 書式5 | 定期報告書 | WORD |
| 書式6 | 軽微変更通知書 | WORD |
| 書式7 | 重大な不適合報告書 | WORD |
| 書式8 | 医薬品の疾病等報告書 | WORD |
| 書式9 | 医療機器の疾病等又は不具合報告書 | WORD |
| 書式10 | 再生医療等製品の疾病等又は不具合報告書 | WORD |
| 書式11 | 中止通知書 | WORD |
| 書式12 | 終了通知書 | WORD |
| 書式13 | 認定臨床研究審査委員会の意見報告書 | WORD |
| 書式14 | 認定臨床研究審査委員会第三者評価報告書 | WORD |
| 書式15 | 認定臨床研究審査委員会第三者評価を受けた改善策 | WORD |
| 詳細記載用書式 | 書式8~10の詳細記載用 | WORD |
| 参考書式1 | 技術専門員評価書 | WORD |
| 参考書式2 | 実施医療機関の要件 | WORD |
| 参考書式4 | 履歴書 | WORD |
| 参考書式5 | 適応外使用該当性確認依頼書 | WORD |
| 参考書式6 | 適応外使用該当性確認書 | WORD |
特定臨床研究の保険診療について
| 番号 | 資料名 | DL |
| 別紙 | 研究対象者負担の費用に関するチェックシート(厚生労働省医政局研究開発政策課からの通知) | WORD |
認定臨床研究審査委員会 提出書類一覧
統括責任者は、申請に必要な書類を揃え臨床研究管理センターへお申込みください。実施計画を厚生労働大臣に提出する場合、特定臨床研究の実施の適否と実施にあたって留意すべき事項について、認定臨床研究審査委員会の意見を聴く必要があります。
新規審査依頼
| 提出書類(※全ての書類は電子媒体で提出)提出先:crmc@m2.kufm.kagoshima-u.ac.jp | 書式 |
| 特定臨床研究の該当性に関するチェックリスト(チェックリスト1) ・審査依頼時に特定臨床研究の該当性についてチェックリストの作成をお願いします。 ・判断に迷う場合は、必要に応じて厚生労働省医政局研究開発政策課へご相談下さい。 |
EXCEL |
| 特定臨床研究の開始手続きに関するチェックリスト(チェックリスト2) ・審査依頼時に特定臨床研究の開始手続きについてチェックリストの作成をお願いします。 ・実施計画の提出後、jRCTに情報が公表されてからでないと研究を開始できません。 |
EXCEL |
| 新規審査依頼書 ・新規実施計画の審査依頼時に使用します。 ・統括責任者が作成し、CRBに提出します。 |
WORD |
| 実施計画(省令様式第1) ・実施計画とは、臨床研究法で定められた様式であり地方厚生局へ届け出が必要となる書類です。 ・鹿児島大学臨床研究審査委員会には、原則、WORDファイルをご提出下さい。 ・事務局確認後、jRCTに登録いただき一時保存の状態で実施計画のPDFを出力いただくようご案内します。 ・臨床研究等提出・公開システム(jRCT)はこちら ・(参考)実施計画の書き方モデル ・(参考)jRCT入力モデル |
WORD |
| 研究計画書 ・臨床研究法で求められる項目を全て記載して、完成したものをご提出ください。 ・研究計画書の内容を実施計画に記載する必要があります。 ・任意の様式でご作成いただくことで差し支えございません。 研究計画書の記載事項(臨床研究法)はこちら |
WORD |
| 説明文書・同意書 ・臨床研究法で求められる項目を全て記載して、完成したものをご提出ください。 ・研究対象者に16歳未満が含まれる場合には、原則アセント文書を作成してください。 ・アセントは文書は年齢での理解度に合わせて記載し、必要に応じてルビを付けてください。 説明文書・同意書の記載事項(臨床研究法)はこちら |
WORD |
| 補償の概要 ・特定臨床研究については補償措置(保険への加入、医療を提供する体制の確保等)を講じること。 ・臨床研究保険について(国大協サービス)より見積依頼書をダウンロードして提出下さい |
- |
| 医薬品等の概要を記載した書類 ・医薬品の場合は最新版の添付文書を提出してください。 ・発売されていない試験薬やいわゆるサプリメントについては、概要が必要となります。 |
- |
| 疾病等が発生した場合の対応に関する手順書 ・多施設共同研究の場合は、施設からの報告や因果関係の決定等の手順を含み作成してください。 ・(参考)▶疾病等が発生した場合の手順書 1.0版 ・(参考)▶疾病等が発生した場合の報告フローチャート 1.0版 |
- |
| 効果安全性評価委員会に関する手順書※作成した場合 ・効果安全性評価委員会を設置する場合には手順書を作成してください。 |
- |
| モニタリングに関する手順書 ・臨床研究法ではモニタリングは必須となります。 |
WORD |
| 監査に関する手順書※作成した場合 | - |
| 利益相反管理基準(様式A) ※様式Aの作成は、利益相反管理計画の作成の手続きを実施下さい。 |
- |
| 利益相反管理計画(様式E) ・様式Eの作成は、利益相反管理計画の作成の手続きを実施下さい。 ・統括管理者、すべての参加施設および統計解析責任者の様式Eの提出が必要となります。 ・参加施設へ作成依頼をし、とりまとめて提出してください。 |
- |
| 研究分担医師リスト ・多施設共同研究の場合、参加施設へ作成依頼をし総括管理者が取りまとめて提出願います。 ・参加施設すべての研究分担医師リストの提出が必要となります。 ・参加施設へ作成依頼をし、とりまとめて提出してください。 |
WORD |
| 統計解析計画書※作成した場合 | - |
| 医学医術に関する学術団体が、適切な診療等の実施に係る指針の公表その他これに類する方法によりその実施を推奨する文書※該当する場合。 ・薬事承認に係る用法等と同程度以下のものについてこちらの「(10)規則第5条第1項関係」参照。 ・規則第5条第1項関係については根拠資料(診療ガイドライン・先行研究・治験成績等)を提出すること。 |
- |
| その他の資料 ・研究対象者負担の費用に関するチェックシート(WORD)※参考:厚生労働省からの通知 ・企業等との契約に関する書類※該当する場合 ・被験者の募集に関する手順や募集広告等の資料※該当する場合 ・実施医療機関の要件(WORD)※該当する場合 ※実施医療機関の要件(1ページ目)は統括管理者が作成します。 ※参加施設へ配布し、各施設にて要件が満たされていれば確認シートを作成します。 ※多施設共同研究の場合、医療機関毎に作成し総括管理者が確認シートを取りまとめて提出ください。 ・履歴書(WORD)※該当する場合 ・研究分担医師に関わる推薦書(WORD)※該当する場合 ・審査手数料の支払のための書類(予算振替依頼書、又は請求書をご案内します。) ・臨床研究保険の見積依頼書(参考:臨床研究保険について(国大協サービス)) |
- |
軽微な変更通知
軽微な変更は、CRBへの通知を行うのみとなっています。軽微な変更後、10日以内に臨床研究管理センターに以下の書類を提出してください。軽微な変更の範囲は「臨床研究法施行規則の施行等について」の「(47)規則第42条関係」で示されている「変更内容が軽微な変更に該当する実施計画上の項目(実施計画上の記載欄の大項目・中項目)」で示されている範囲のみです。
| 提出書類(※全ての書類は電子媒体で提出)提出先:crmc@m2.kufm.kagoshima-u.ac.jp | 書式 |
| 軽微変更通知書 | WORD |
| 実施計画事項軽微変更届書(様式第三) ・jRCTの「軽微変更」より実施計画事項軽微変更届書を作成いただきます。 ・一時保存の状態で「実施計画事項軽微変更届書」のPDFを出力したものを提出願います。 ・臨床研究等提出・公開システム(jRCT)はこちら |
- |
| 実施計画 ・jRCTの「軽微変更」より実施計画事項軽微変更届書を作成いただきます。 ・一時保存の状態で「実施計画」のPDFを出力したものを提出願います。 |
- |
変更審査依頼
統括管理者は実施計画の変更にあたっては、軽微な変更を除き、実施計画及び実施計画事項変更届出書(省令様式第2)を作成してCRBに変更審査依頼を提出ください。変更審査が承認後、統括管理者は研究責任医師に承認の旨を通知し、各実施医療機関の研究責任医師は管理者の研究の実施許可を取得ください。統括管理者は、jRCTを通じて実施計画事項変更届出書(省令様式第2)を「変更」より届出してください。実施計画の変更について、jRCTに公開されたことをCRBと研究責任医師に通知いただき、研究責任医師は管理者へ実施計画を提出した旨を報告してください。
研究計画書、利益相反管理基準又は利益相反管理計画を変更する場合においては、実施計画の変更の可能性があることからCRBの意見を聴いてください。その結果、実施計画の変更がない場合はjRCT登録は不要です。
既に鹿児島大学臨床研究審査委員会に提出されている書類に変更がないときは、その提出を省略する事ができます。
| 提出書類(※全ての書類は電子媒体で提出)提出先:crmc@m2.kufm.kagoshima-u.ac.jp | 書式 |
| 変更審査依頼書 ・統括責任者が作成し、CRBに提出します。 ・変更時又は新たな資料の追加時に使用します。 |
WORD |
| 実施計画事項変更届出書(省令様式第2) ・jRCTの「変更」より実施計画事項変更届出書(省令様式第2)を作成いただきます。 ・一時保存の状態で実施計画事項変更届出書(省令様式第2)のPDFを出力したものを提出願います。 ・臨床研究等提出・公開システム(jRCT)はこちら |
- |
| 実施計画(省令様式第1) ・jRCTの「変更」より実施計画(省令様式第1)を作成いただきます。 ・一時保存の状態で実施計画(省令様式第1)のPDFを出力したものを提出願います。 ・臨床研究等提出・公開システム(jRCT)はこちら |
- |
| 変更対比表 ・改訂箇所は変更対比表に変更前・変更後を記載し、改訂理由を明記ください。 ・変更項目について、適宜増減させて使用ください。 ・改訂した書類(研究計画書、説明文書・同意書、各種手順書等)を添えて提出ください。 |
WORD |
| 改訂書類(研究計画書、説明文書・同意書、各種手順書等) ・改訂箇所は変更対比表に変更前・変更後を記載し、改訂理由を明記ください。 ・改訂書類について、改訂箇所は下線を引いて分かりやすく示してください。 |
- |
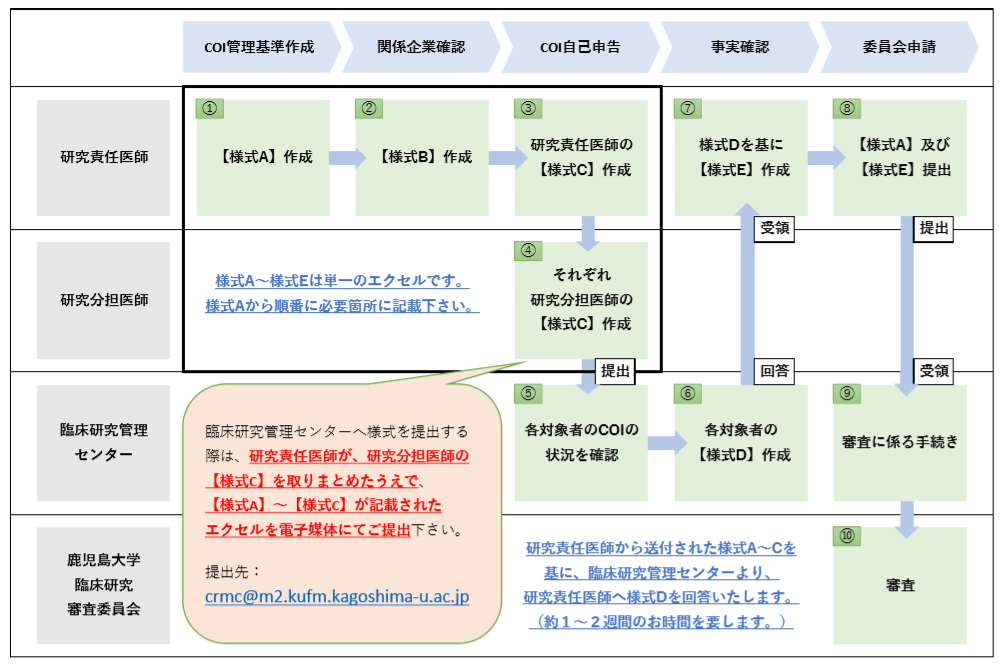
臨床研究法における利益相反管理について
統括管理者は、臨床研究に対する医薬品等製造販売業者等による関与について、様式AからCを作成して、助言・指導を受け様式Dを受領することが定められています。臨床研究管理センターでは、COI申告者の申告内容に応じて利益相反管理に係る確認業務を行っております。
利益相反申告者について
①製薬企業等に属さない個人の統括責任者
②研究責任医師、研究分担医師
③医学的知識に基づく助言を行う者
④統計解析責任者 など
利益相反管理のための留意事項
統括管理者・研究責任医師は、以下①から⑤に該当する場合、統括管理者・研究責任医師から外れること。
また、該当している場合にも関わらず関与する場合、監査を受けること(統計解析等は不可)。
配偶者や親族が②から④に該当する場合、統括管理者・研究責任医師は統計解析等は不可。
研究分担医師が①から⑤に該当する場合、統計解析等は不可。
①当該臨床研究の製薬企業の寄付口座に所属、かつ拠出した資金で給与を得ている。
②当該臨床研究の製薬企業から当該年度、前年度に年間合計250万円以上の個人的利益を得ている。
③当該臨床研究の製薬企業の役員である。
④当該臨床研究の製薬企業の株式を保有している。
⑤当該臨床研究の製薬企業の医薬品等の特許権を保有、あるいは特許出願している。
・法人又は団体の統括管理者である場合、共済費の申告書(様式X)を作成すること。
・法人又は団体の統括管理者が年間1000万円以上の場合、又は製薬企業に属する個人の場合、監査を受けること。
・利益相反管理書類の提出は、研究開始時だけでなく1年ごとの定期報告時にも求められます。
・利益相反に係る様式(様式A、B、C、D、E、X)に関して、下記よりダウンロード願います。
| 提出書類(※全ての書類は電子媒体で提出)提出先:crmc@m2.kufm.kagoshima-u.ac.jp | 書式 |
| 利益相反に係る様式(様式A、B、C、D、E、X) ・COI申告者は、様式A、様式B、様式Cを作成して臨床研究管理センターに提出ください。 ・数日後、様式Dを回答致しますので、確認結果に基づき様式Eを作成ください。 ・新規審査依頼や定期報告の際に、様式Aと様式EをCRBに提出ください。 |
EXCEL |
| (参考)臨床研究法における利益相反管理ガイダンス |
| (参考)臨床研究法における利益相反管理に関する標準業務手順書 |
利益相反管理のプロセス
定期報告
統括管理者は、臨床研究の実施状況・疾病等の発生状況について、実施計画の公表日から1年毎に当該期間満了後2ヶ月以内に、CRBに定期報告を提出ください。統括管理者は、承認後は研究責任医師に通知し、研究責任医師は実施医療機関の管理者にその旨を報告して下さい。統括管理者は、CRBが意見を述べた日から起算して1か月以内にjRCTの「定期報告」より定期報告書(省令様式3)に従って入力を行い、厚生労働大臣に届出を行って下さい。
・報告期限:実施計画の公表日より、1年ごと、2か月以内に取りまとめて報告
(例)公表日が2019年3月18日の場合:
2019年3月18日~2020年3月17日の期間について、2020年5月17日までにCRBへ定期報告する。
| 提出書類(※全ての書類は電子媒体で提出)提出先:crmc@m2.kufm.kagoshima-u.ac.jp | 書式 |
| 定期報告書【統一書式5】 ▶統括管理者は下記の事項について記載し、実施状況を報告すること。 ・研究に参加した特定臨床研究の対象者の数 ・研究に係る疾病等の発生状況及びその後の経過 ・省令又は研究計画書に対する不適合の発生状況及びその後の対応 ・研究の安全性及び科学的妥当性についての評価 ・研究に対する利益相反に規定する関与に関する事項 |
WORD |
| 定期報告書【別紙様式3】 ・jRCTの「定期報告」より定期報告書【別紙様式3】を作成いただきます。 ・一時保存の状態で定期報告書【別紙様式3】のPDFを出力したものを提出願います。 ・臨床研究等提出・公開システム(jRCT)はこちら |
WORD |
| 利益相反管理基準(様式A) ※様式Aの作成は、利益相反管理計画の作成の手続きを実施下さい。 |
- |
| 利益相反管理計画(様式E) ・様式Eの作成は、利益相反管理計画の作成の手続きを実施下さい。 ・統括管理者、すべての参加施設および統計解析責任者の様式Eの提出が必要となります。 ・参加施設へ作成依頼をし、とりまとめて提出してください。 |
- |
| 臨床研究法における臨床研究に関する報告書 ・統括管理者から情報提供を受けた研究責任医師が管理者に報告を行う際の院内書式です。 ・報告事項に関連する書類を添付資料に記載してご提出願います。 |
WORD |
実施医療機関の管理者による研究実施許可申請について
実施医療機関の管理者による実施の適否とは
特定臨床研究を実施するにあたって研究責任医師は、認定臨床研究審査委員会の意見を聴き「承認」を受けた後に、下記の書類を臨床研究管理センターへ提出し、臨床研究を適切に実施する実施体制を備えているか等の観点から研究実施の可否について鹿児島大学病院長の許可を受ける必要があります。
研究実施許可の申請方法
▶ご案内する下記の①~③の書類を臨床研究管理センターまでご提出下さい。
▶①「研究実施許可願の申請書」について、下記よりダウンロードし、提出書類と併せてご提出下さい。
▶②「審査結果通知書(統一書式4)」※既に承認を得た認定臨床研究審査委員会より通知されたもの
▶③「承認書類一式」※認定臨床研究審査委員会で承認されたもの
| □研究実施許可願の申請書(研究責任医師→鹿児島大学病院長) |
▶後日、臨床研究に関する決定通知書を申請者の方へ送付いたします。
厚生労働大臣へ実施計画を提出した旨の管理者報告と認定臨床研究審査委員会への通知について
厚生労働大臣へ実施計画を提出した旨の管理者報告と認定臨床研究審査委員会への通知とは
厚生労働大臣へ実施計画を提出後、jRCT登録が完了し研究情報が公表されたら、研究責任医師(多施設共同研究の場合は研究代表医師)は各実施医療機関の管理者に「厚生労働大臣へ実施計画を提出した」旨の報告が必要となります。さらに、当該実施計画に記載された認定臨床研究審査委員会へ通知する必要があります。(法第6条、規則第39条)なお、報告期限は定められておりませんが、臨床研究法施行規則第39条にて「速やかに」報告しなければならないとされておりますので、迅速にご対応をお願いします。
厚生労働大臣へ実施計画を提出した旨の管理者への報告方法
▶ご案内する下記の2点の書類を臨床研究管理センターまでご提出下さい。
▶「臨床研究法における臨床研究に関する報告書」について、下記よりダウンロードし、必要事項を
記載して電子媒体もしくは紙媒体にてご提出下さい。
▶「研究情報が記載されたjRCT出力画面」※既にjRCTへ登録が完了している場合、下記のリンクより
jRCTにアクセスし、研究情報をweb上で確認することができます。
jRCTより報告対象の研究を検索し、臨床研究情報の詳細が閲覧可能ですので、そのjRCTのweb画面を
印刷し、ご提出下さい。
▶jRCTへのアクセスはこちら(https://jrct.niph.go.jp/search)
| □臨床研究法における臨床研究に関する報告書(研究責任医師→病院長) |
| □ 研究情報が記載されたjRCT出力画面 |
厚生労働大臣へ実施計画を提出した旨の鹿児島大学臨床研究審査委員会への通知方法
▶ご案内する下記の2点の書類を臨床研究管理センターまでご提出下さい。
▶「臨床研究法における臨床研究に関する通知書」について、下記よりダウンロードし、必要事項を
記載して電子媒体もしくは紙媒体にてご提出下さい。
▶「研究情報が記載されたjRCT出力画面」※既にjRCTへ登録が完了している場合、下記のリンクより
jRCTにアクセスし、研究情報をweb上で確認することができます。
jRCTより報告対象の研究を検索し、臨床研究情報の詳細が閲覧可能ですので、そのjRCTのweb画面を
印刷し、ご提出下さい。
▶jRCTへのアクセスはこちら(https://jrct.niph.go.jp/search)
| □臨床研究法における臨床研究に関する通知書(研究責任医師→鹿児島大学臨床研究審査委員会 委員長) |
| □ 研究情報が記載されたjRCT出力画面 |
医薬品疾病等報告
臨床研究の実施中に研究の実施によると疑われる疾病等が発生した場合は、
実施医療機関への管理者、厚生労働大臣並びに認定臨床研究審査委員会への報告が必要です。
▶報告の流れに関して、下記より疾病等が発生した場合のフローチャートをご参照ください。
運営規則等>疾病等が発生した場合のフローチャート
厚生労働大臣への疾病等報告
▶厚生労働大臣への報告が必要となるのは、未承認・適応外の医薬品等を用いた特定臨床研究に限られており、
そのなかでも、特定臨床研究との因果関係があり、予測されない(未知)、重篤な事象のみが報告対象となります。
▶厚生労働大臣への報告は、jRCT上で必要な情報の入力を行い、報告に必要な添付資料等をアップロードしたうえで、
医薬品医療機器総報・企画管理部 情報管理課宛てに送信下さい。
▶詳細な入力方法はjRCTにログインし、操作マニュアルを参照ください。
認定臨床研究審査委員会への疾病等報告
▶認定臨床研究審査委員会へ疾病等報告を行なう場合は、以下の統一書式をダウンロードし、必要事項を入力して
委員会事務局へご提出ください。法で定められる報告期限を遵守してご提出ください。
| ▶医薬品疾病等報告書:統一書式8 ※厚生労働大臣への報告様式(別紙様式2-1を添付) |
| ▶医療機器疾病等又は不具合報告書:統一書式9 ※厚生労働大臣への報告様式(別紙様式2-2を添付) |
| ▶再生医療等製品疾病等又は不具合報告書:統一書式10 |
| ▶詳細記載用書式 |
実施医療機関の管理者への疾病等報告
▶実施医療機関の管理者への疾病等報告を行う場合は、疾病等報告に係る関連資料等を添えて、
「臨床研究法における臨床研究に関する報告書」を臨床研究管理センターにご提出下さい。
| □臨床研究法における臨床研究に関する報告書 |
| 疾病等報告に係る関連資料等(統一書式8~10、詳細記載用書式、別紙様式2-1、2-2、CRBの意見書等) |
★お問い合わせはこちら
鹿児島大学病院 臨床研究管理センター
電話 099-275-6624 内線(6624)
E-mail:crmc@m2.kufm.kagoshima-u.ac.jp

 HOME
HOME 病院紹介
病院紹介 受診される方へ
受診される方へ 医療関係者の方へ
医療関係者の方へ 診療科案内
診療科案内 部門案内
部門案内 よくある質問
よくある質問 お問合せ
お問合せ アクセス・駐車場
アクセス・駐車場


