臨床研究管理センター
臨床研究管理センターとは
治験審査委員会に関するご案内はこちら
臨床研究を始める前に
人を対象とする生命科学・医学系研究に関する倫理指針(2021年6月30日施行)関連
臨床研究法関連
「人を対象とする生命科学・医学系研究に関する倫理指針」の制定について
「人を対象とする医学系研究に関する倫理指針」と「ヒトゲノム・遺伝子解析研究に関する倫理指針」が統合され、令和3年3月23日付けで「人を対象とする生命科学・医学系研究に関する倫理指針」が制定されました。また、令和3年4月16日付けで「人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス」が公開されています。「生命科学・医学系研究」には、「ゲノム指針」におけるヒトゲノム・遺伝子解析研究が含まれ、「医学系指針」における医学系研究も含まれます。
上記審査対象に該当する研究を実施される方は、本学倫理委員会への倫理審査申請書・研究計画書の提出及び研究計画に関する研究機関長の許可を得るまで研究を開始する事ができません。申請から許可まで時間を要する場合がありますので、委員会開催スケジュールを確認の上、余裕を持って申請してください。
人を対象とする生命科学・医学系研究に関する倫理指針(2021年6月30日施行)
こちらから必ずご確認頂きますようお願い申し上げます。
研究に関する指針について |厚生労働省 (mhlw.go.jp)
| 人を対象とする生命科学・医学系研究 |
| 人を対象として、次のア又はイを目的として実施される活動をいう。 ア 次の①、②、③又は④を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること。 ①傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)の理解 ②病態の理解 ③傷病の予防方法の改善又は有効性の検証 ④医療における診断方法及び治療方法の改善又は有効性の検証 イ 人由来の試料・情報を用いて、ヒトゲノム及び遺伝子の構造又は機能並びに遺伝子の変異又は発現に関する知識を得ること。 |
臨床研究倫理委員会・疫学研究等倫理委員会の委員会情報
研究者等から申請のあった生命科学・医学系研究の実施計画の倫理的妥当性等について審査をするため、鹿児島大学桜ヶ丘地区には次の倫理審査委員会が設置されています。
倫理審査委員会の正式名称
▶鹿児島大学桜ヶ丘地区臨床研究倫理委員会
Ethics Committee on Clinical Research, Sakuragaoka Campus, Kagoshima University
▶鹿児島大学桜ヶ丘地区疫学研究等倫理委員会
Ethics Committee on Epidemiological and its related Studies, Sakuragaoka Campus, Kagoshima University
運営規則・公開情報等
▶鹿児島大学桜ヶ丘地区における人を対象とする生命科学・医学系研究に関する倫理規則
審査手数料等の設定
臨床研究倫理委員会・疫学研究等倫理委員会への審査依頼に係る審査手数料は設定されておりません。
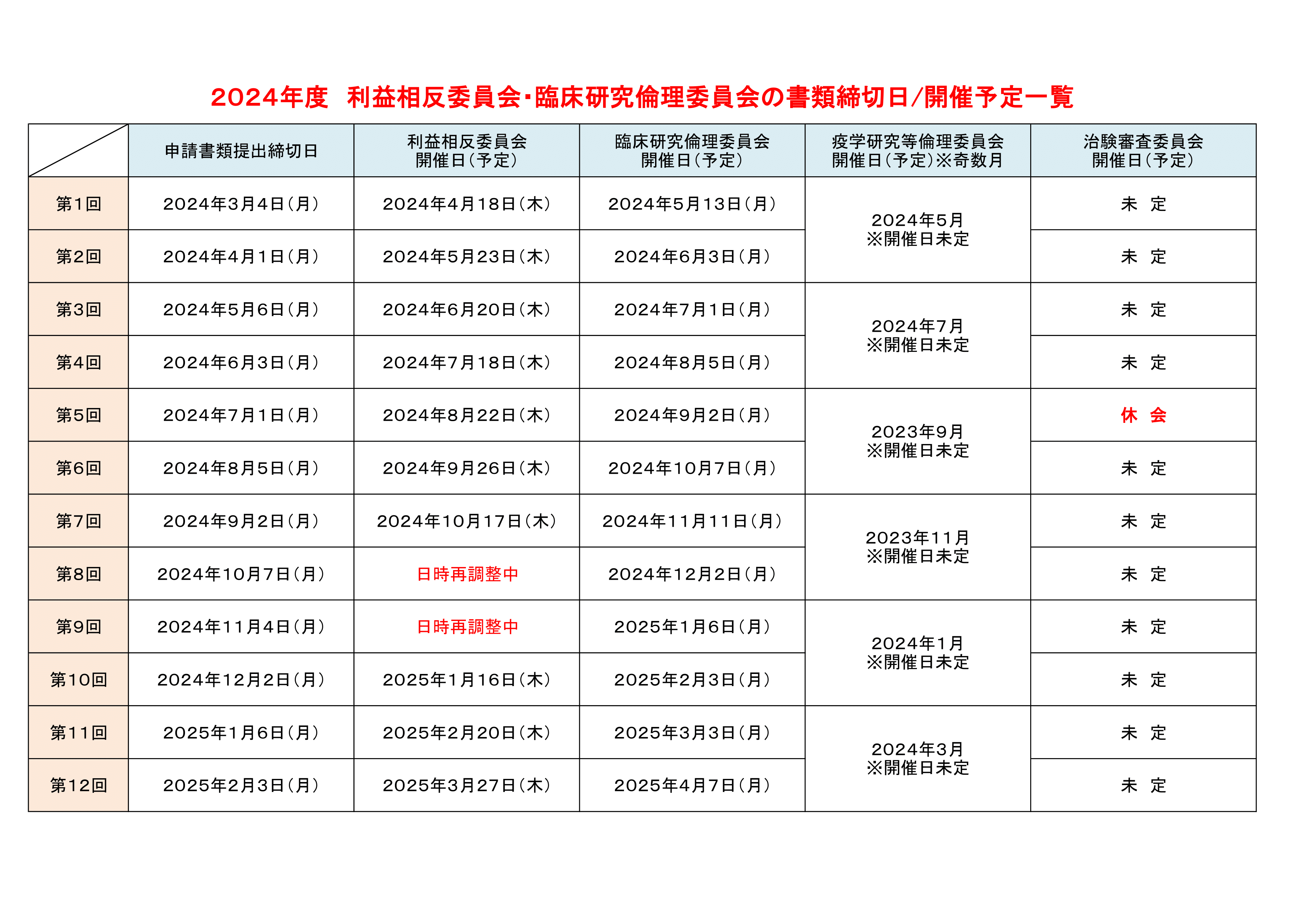
2024年度 利益相反委員会・臨床研究倫理委員会の書類締切日/開催予定
書類締切日/開催予定のご案内
①利益相反委員会開催日:原則として毎月第3木曜日
②臨床研究倫理委員会開催日:原則として毎月第1月曜日
(委員の都合等により変更される場合があります。)
【治験審査委員会へ新規治験を申請する治験責任医師及び治験分担医師の先生へ】
自己申告書(概要)(全員)及び自己申告書(詳細)(該当者のみ)を治験責任医師が取りまとめのうえ、臨床研究管理センターにご提出ください。ご不明点は、治験管理部門・担当CRCまでお問い合わせください。
| 下記の画像はこちらよりPDFダウンロード可能です。 |
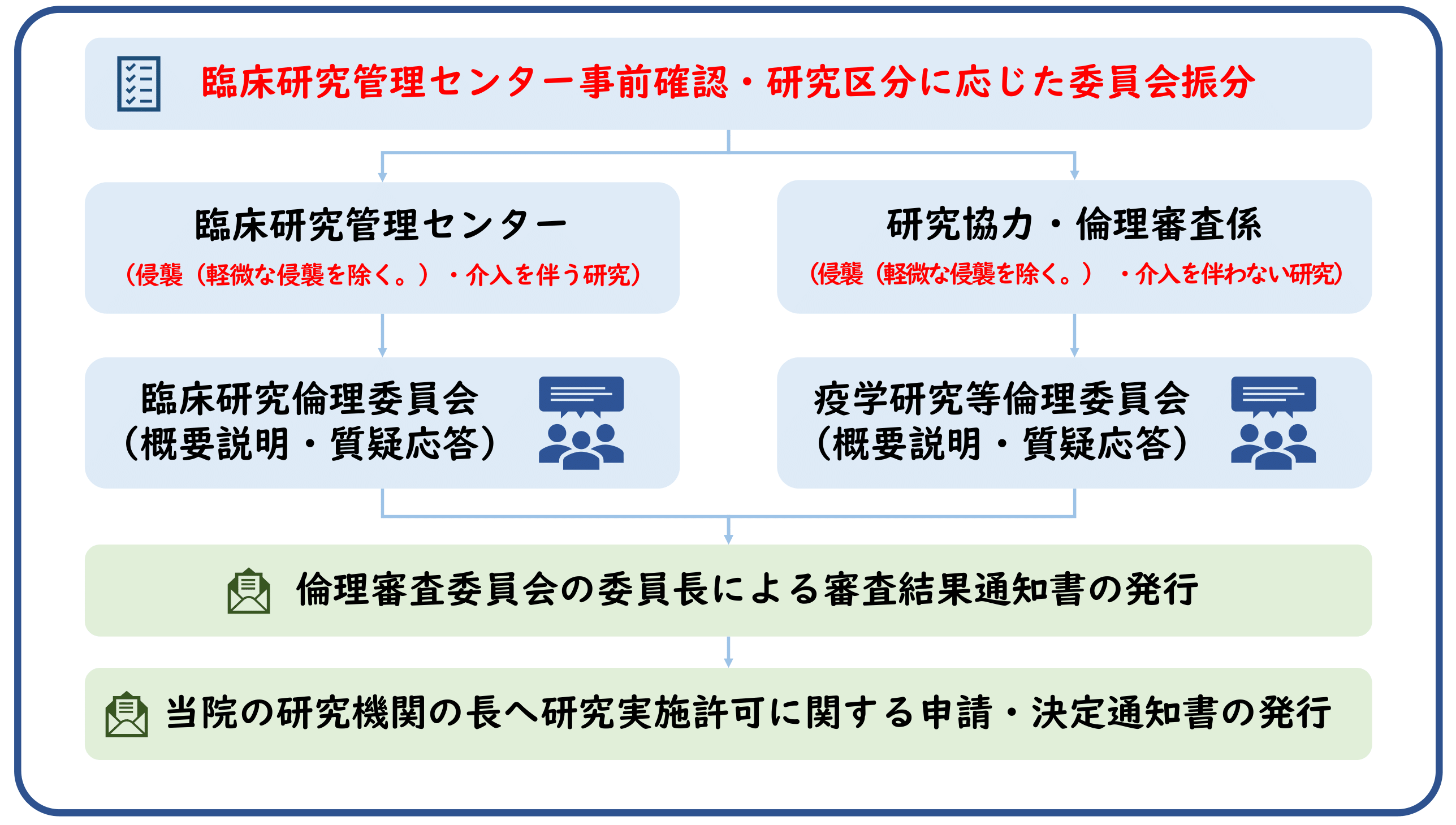
臨床研究倫理委員会・疫学研究等倫理委員会への新規審査依頼
新規審査依頼
研究責任者(多機関共同研究の場合は研究代表者)は、研究を実施しようとするときは、あらかじめ研究計画書等を作成し、実施の適否について倫理審査委員会に意見を聴く必要があります。研究責任者(多機関共同研究の場合は研究代表者)は、申請に必要な書類を揃え、臨床研究管理センターへお申込みください。
★多機関共同研究の一括した審査を希望される研究代表者はこちらも併せてご確認願います。
■提出先:臨床研究管理センター(crmc@m2.kufm.kagoshima-u.ac.jp)
申請書類一式は臨床研究管理センター宛てに電子メールで送信願います。
利益相反自己申告書(概略)及び利益相反自己申告書(詳細)は学内便で送付願います。
※本学サーバー移行に伴いメール不着にて受理できない事象が発生しております。申請後1ヶ月以上返信がない場合はセンター(内線6624)までご連絡ください。
新規審査依頼の流れ
新規審査依頼の提出書類

項1~4に該当する研究は直下の案内を参照して提出書類をダウンロード願います。
項5~8に該当する研究の提出書類はこちらを参照願います。
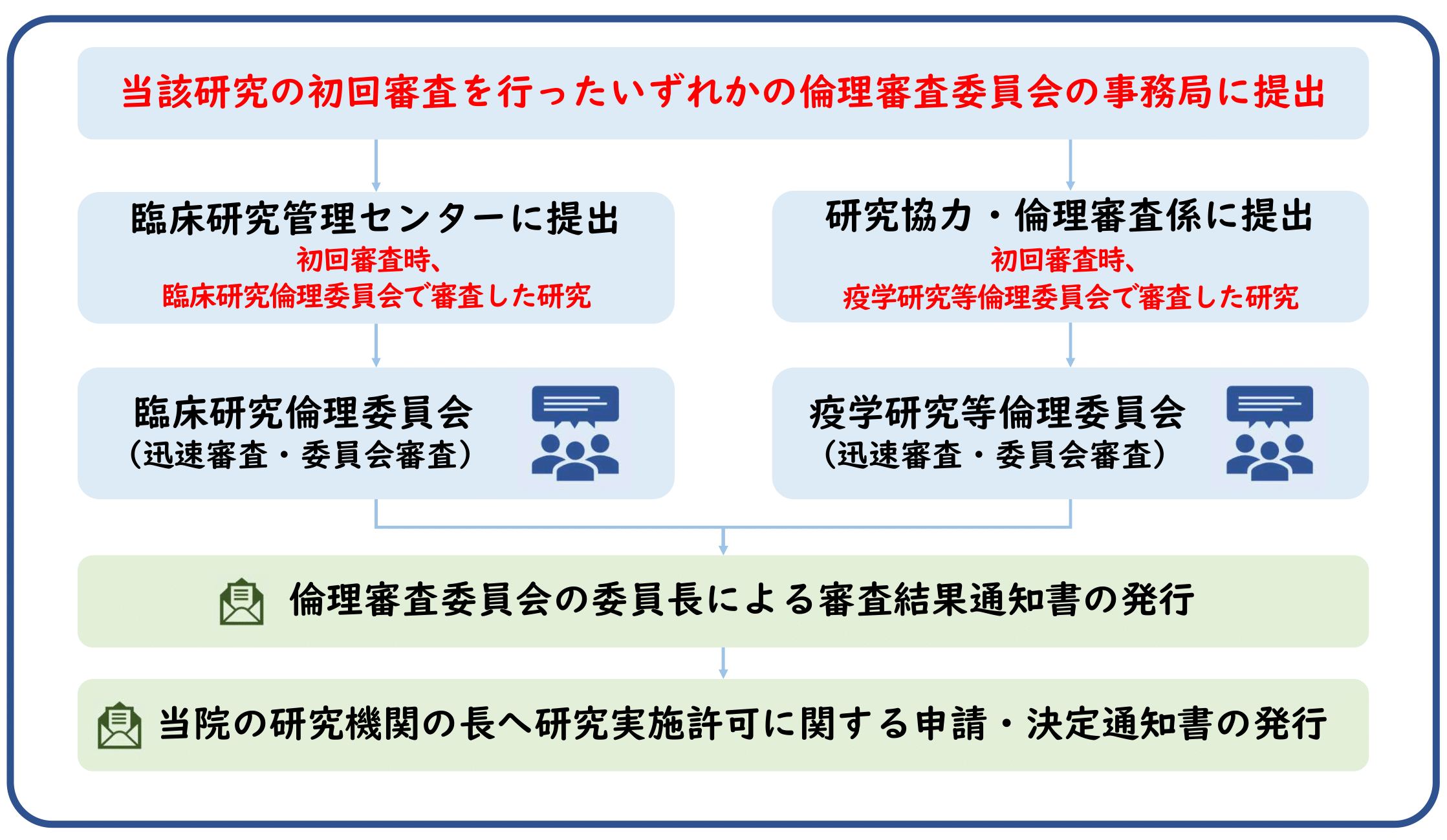
臨床研究倫理委員会・疫学研究等倫理委員会への変更審査依頼
研究責任者(多機関共同研究の場合は研究代表者)は、倫理審査委員会の審査対象となる文書が追加、更新又は改訂された場合、継続の適否について倫理審査委員会に意見を聴く必要があります。研究責任者(多機関共同研究の場合は研究代表者)は、申請に必要な書類を揃え、当該研究の初回審査を行ったいずれかの倫理審査委員会の事務局へお申込みください。
■初回審査時、臨床研究倫理委員会で審査した研究の提出先:臨床研究管理センター(crmc@m2.kufm.kagoshima-u.ac.jp)
申請書類一式は臨床研究管理センター宛てに電子メールで送信願います。
利益相反自己申告書(概略)及び利益相反自己申告書(詳細)は学内便で送付願います。
※本学サーバー移行に伴いメール不着にて受理できない事象が発生しております。申請後、3日以上返信がない場合はセンター(内線6624)までご連絡ください。
■初回審査時、疫学研究等倫理委員会で審査した研究の提出先:研究協力・倫理審査係(isgskkrs@kuas.kagoshima-u.ac.jp)
疫学研究等倫理委員会 | 鹿児島大学大学院 医歯学総合研究科 (kagoshima-u.ac.jp)
変更審査依頼の流れ
変更審査依頼の提出書類
| 提出書類一覧 |
| 生命科学・医学系研究倫理審査申請書(変更) |
| 研究実施許可願の申請書 |
| 変更対比表 |
| 改訂を行った書類 ※改訂用の最新様式はこちら(ZIP) |
臨床研究倫理委員会・疫学研究等倫理委員会への中央一括審査の依頼
鹿児島大学桜ヶ丘地区臨床研究倫理委員会及び鹿児島大学桜ヶ丘地区疫学研究等倫理委員会では多機関共同研究について、原則、中央一括審査を行います。多機関共同研究を実施しようとする研究代表者は下記の事項に留意した上で一括した審査の申請に必要な書類を揃え、臨床研究管理センターへお申込みください。
多機関共同研究の研究計画書を申請しようとする研究代表者が留意すべき事項
▶多機関共同研究とは一の研究計画書に基づき複数の研究機関において実施される研究のことです。多機関共同研究を実施する研究責任者は、当該多機関共同研究として実施する研究に係る業務を代表するため、研究責任者の中から、研究代表者を選任願います。
▶当委員会への多機関共同研究の審査依頼に係る窓口のとりまとめ役として、研究代表者又はその役割を担う方(実際の担当者や研究事務局)に行って頂きます。
▶研究代表者は、多機関共同研究を実施しようとする場合には、各共同研究機関の研究責任者の役割及び責任を明確にした上で一の研究計画書を作成又は変更する必要があります。多機関共同研究の新規審査依頼または変更審査依頼は研究代表者が取りまとめて申請願います。
▶説明文書及び同意文書の様式は、一の研究計画書について一の様式とする必要があります。多機関共同研究の様式にあっては、各研究機関の研究対象者に対する説明及びその同意に関する記載内容が一致するよう研究機関ごとに固有の事項(研究責任者名や相談窓口の連絡先等)以外の共通する事項を記載願います。
▶研究代表者は、共同研究機関の研究責任者間で当該研究に関連する必要な情報(研究の進捗状況の管理・監督及び有害事象等の把握・報告など)の共有が円滑になされるよう窓口等を設けるなど留意願います。
▶個々の研究者の利益相反について、各研究機関の利益相反委員会で審査を受けるなどして適切に管理願います。研究代表者は研究の実施体制に含まれる研究者等の利益相反に関する状況が適切に管理され研究計画書や説明文書・同意書にその内容が適切に記載されていることを確認願います。
▶倫理審査委員会から審査結果通知書が発行された後、研究代表者は審査結果通知書等を各共同研究機関へ情報提供し、各共同研究機関の研究責任者は各研究機関の長より研究の実施の許可を受けたうえで研究を実施願います。
▶介入を行う研究について、厚生労働省が整備するデータベース(Japan Registry of Clinical Trials: jRCT)等の公開データベースに、当該研究の概要をその実施に先立って登録し、研究計画書の変更及び研究の進捗に応じて更新する必要があります。多機関共同研究を実施する場合は、研究計画書に定めた役割に応じて、研究代表者が一元的に登録してよいです。その場合、当該研究に参加する全ての共同研究機関に関する情報を登録する必要があるので、留意してください。なお、登録は、研究機関の長から実施の許可を受けた研究計画書に記載された研究期間が始まる前に行う必要があります。
多機関共同研究に参加する共同研究機関の研究責任者が留意すべき事項
中央一括審査では研究計画書など全施設で共通して用いる資料については、共同研究機関は提出不要となります。多機関共同研究に参加する際、自施設にて研究に関する利益相反状況、教育・研修が適切に実施・管理されていることを確認した上で下記の書類をご作成願います。共同研究機関が作成する書類は多機関共同研究の研究代表者が取りまとめてご提出願います。
臨床研究倫理委員会・疫学研究等倫理委員会で行う中央一括審査の流れ
| 下記の画像はこちらよりPDFダウンロード可能です。 |
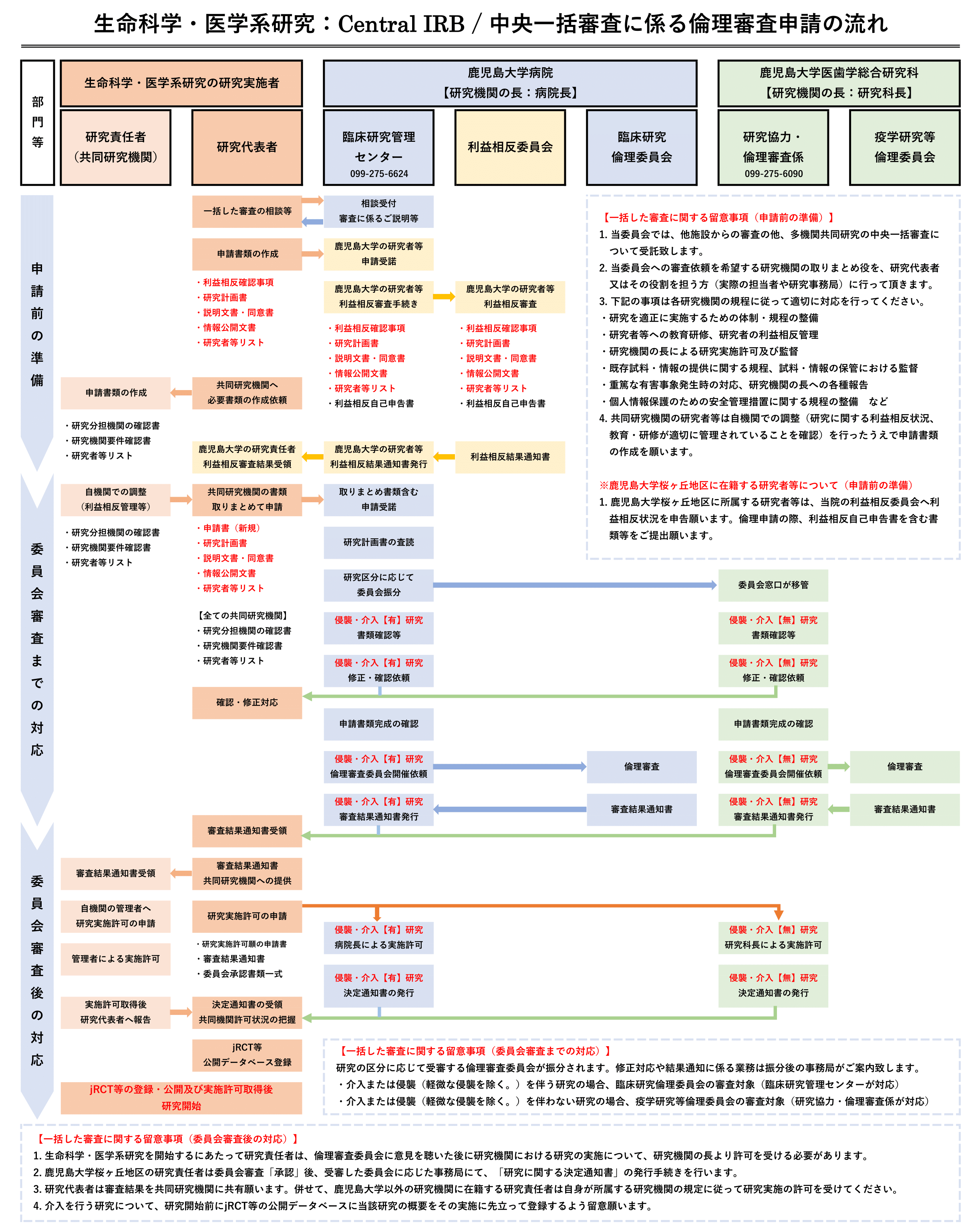
中央一括審査に関する書類提出先
中央一括審査に関する書類提出先は、通常の審査と同様となります。
新規審査依頼の場合、こちらをご覧下さい。変更審査依頼の場合、こちらをご覧下さい。
中央一括審査依頼の提出書類(新規審査依頼)
鹿児島大学桜ヶ丘地区の研究機関の長による研究実施許可
鹿児島大学桜ヶ丘地区に在籍する研究責任者は、倫理審査委員会に意見を聴いた後に、審査結果通知書及び倫理審査委員会に提出した書類、「研究実施許可願の申請書」を研究機関の長に提出し、当該研究機関における当該研究の実施について、許可を受けるようお願い致します。
生命科学・医学系研究の実施許可願の申請をしようとする研究責任者が留意すべき事項
| 「人を対象とする生命科学・医学系研究に関する倫理指針ガイダンス」より抜粋 |
| ▶第3章 研究の適正な実施等 第6 研究計画書に関する手続 3 研究機関の長による許可等 (1)研究機関の長は、研究責任者から研究の実施の許可を求められたときは、倫理審査委員会の意見を尊重しつつ、当該研究の実施の許可又は不許可その他研究に関し必要な措置について決定しなければならない。この場合において、研究機関の長は、倫理審査委員会が研究の実施について不適当である旨の意見を述べたときには、当該研究の実施を許可してはならない。 →(1)の規定について、研究機関の長は、当該研究を自機関で適切に実施する実施体制を備えているか等の観点から、研究の実施の許可又は不許可を検討し、文書により通知すること。当該研究計画書の変更が生じた場合も同様とする。▶第6章 研究の信頼性確保 第11 研究に係る適切な対応と報告 3 大臣への報告等 (1)研究機関の長は、当該研究機関が実施している又は過去に実施した研究について、この指針に適合していないことを知った場合(…略…)には、速やかに倫理審査委員会の意見を聴き、必要な対応を行うとともに、不適合の程度が重大であるときは、その対応の状況・結果を厚生労働大臣(…略…)に報告し、公表しなければならない。 →下記に例示するような場合は、研究の内容にかかわらず、不適合の程度が重大であると考えられ、大臣に報告し公表する必要がある。 ・倫理審査委員会の審査又は研究機関の長の許可を受けずに、研究を実施した場合 |
→つきましては、新規・変更審査の承認後は必ず「研究に関する決定通知書」の発行を受けてから研究開始願います。
| 様式 |
| ■研究実施許可願の申請書(研究責任者→研究機関の長) |
研究実施許可願の申請に関する提出書類


およそ1週間から2週間を目処に「研究に関する決定通知書」を学内便で郵送します。
他の研究機関へ既存試料・情報を提供する場合の手続き
鹿児島大学桜ケ丘地区の部局の保有する既存試料・情報を他の研究機関に提供する場合、倫理審査委員会の承認を得て、研究機関の長の実施許可を受けなければなりません。ただし、鹿児島大学桜ケ丘地区の部局が研究に参加することなく、保有する既存試料・情報の提供のみを行う場合であって、当該既存試料・情報が次に掲げるいずれかに該当している場合、倫理審査委員会の審査は不要とし、「他の研究機関への試料・情報の提供に関する(申請・報告)書」を予め提出のうえ、研究機関の長の承認を得たうえで、既存試料・情報の提供のみを行う必要があります。
| 人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス第4章第8 1(4)イ 既存試料・情報の提供のみを行う者は、(3)ア(ア)又はイ(ア)①若しくは(イ)①により既存試料・情報の提供を行う場合、その提供について既存試料・情報の提供のみを行う機関の長が把握できるようにすること |
 |
| 様式 |
| ■他の研究機関への試料・情報の提供に関する(申請・報告)書 |
既存試料・情報を提供する場合の提出書類

他の研究機関へ試料・情報を提供する場合の手続き
鹿児島大学病院または鹿児島大学医歯学総合研究科において、研究協力機関として、当該研究のために研究対象者から新たに試料・情報を取得し(侵襲(軽微な侵襲を除く。)を伴う試料の取得は除く。)、研究機関に提供のみを行う場合、倫理審査委員会の審査は不要とし、「他の研究機関への試料・情報の提供に関する(申請・報告)書」を予め提出のうえ、研究機関の長の承認を得たうえで、試料・情報の提供のみを行う必要があります。
| 様式 |
| ■他の研究機関への試料・情報の提供に関する(申請・報告)書 |
試料・情報を提供する場合の提出書類

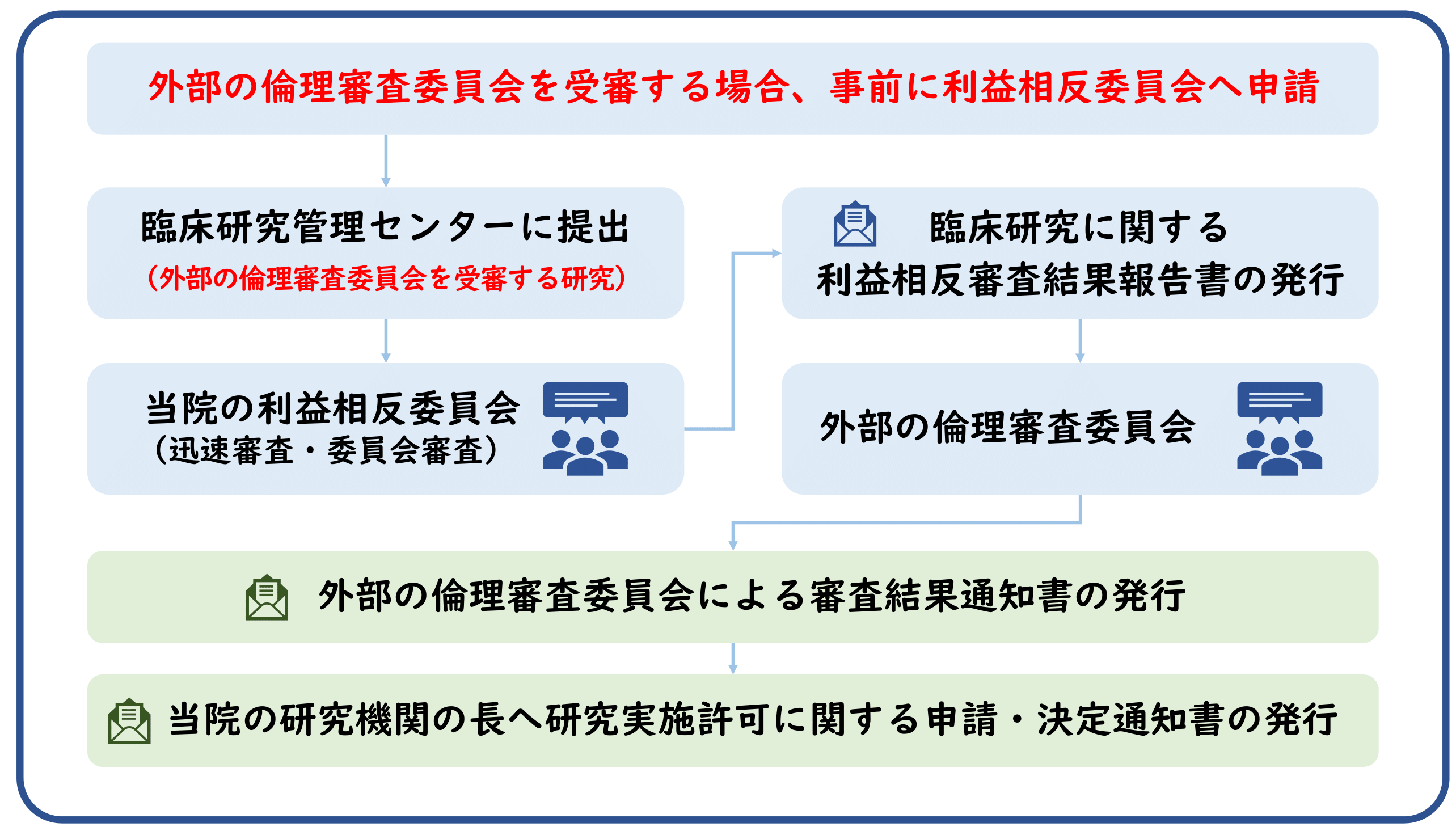
外部の倫理審査委員会を受審し研究を開始する手続き
外部の倫理審査委員会を受審しようとする鹿児島大学桜ヶ丘地区の研究者等は、当院の利益相反委員会へ当該研究の利益相反に関する状態を申告した上で審査を受ける必要があります。また、外部の倫理審査委員会より研究の実施について適当である旨の意見が述べられた場合、「研究実施許可願の申請書」を研究機関の長に提出し、当該研究機関における当該研究の実施について、許可を受けるようお願い致します。
鹿児島大学の利益相反委員会への提出書類
| 提出書類一覧 |
| 利益相反確認事項(生命科学・医学系研究倫理審査申請書(新規)p6の添付書類) |
| 研究実施許可願の申請書 |
| 利益相反自己申告書(概略) |
| 利益相反自己申告書(詳細)※ 利益相反自己申告書(概略)1.~4.の項目で「有」がある場合 |
| 研究者等リスト |
| 研究計画書 ※外部の倫理審査委員会を受審する際に提出する書類 |
| 説明文書・同意書 又は 情報公開文書 ※外部の倫理審査委員会を受審する際に提出する書類 |
審査後に「臨床研究に係る利益相反審査結果報告書」を発行致します。
外部の倫理審査委員会に意見を聴いた後の研究実施許可願の申請
外部の倫理審査委員会に意見を聴いた後に、審査結果通知書及び倫理審査委員会に提出した書類、「研究実施許可願の申請書」を研究機関の長に提出し、当該研究機関における当該研究の実施について、許可を受けるようお願い致します。研究機関の長による研究実施許可について、留意事項も含めてこちらをご覧下さい。
外部の倫理審査委員会で行う中央一括審査の流れについて
研究の概要の登録
研究責任者(多機関共同研究の場合は研究代表者)は、介入を行う研究について、厚生労働省が整備するデータベース(Japan Registry of Clinical Trials : jRCT) 等の公開データベースに、当該研究の概要をその実施に先立って登録し、研究計画書の変更及び研究の進捗に応じて更新する必要があります。また、それ以外の研究についても当該研究の概要をその研究の実施に先立って登録し、研究計画書の変更及び研究の進捗に応じて更新するよう努めなければなりません。
★データベース登録は、研究機関の長から実施の許可を受けた研究計画書に記載された研究期間が始まる前に行う必要がありますのでご留意願います。
| 公開データベース |
| 臨床研究実施計画・研究概要公開システム (niph.go.jp) |
| UMIN臨床試験登録システム(UMIN-CTR) |
| 国立保健医療科学院のホームページ |
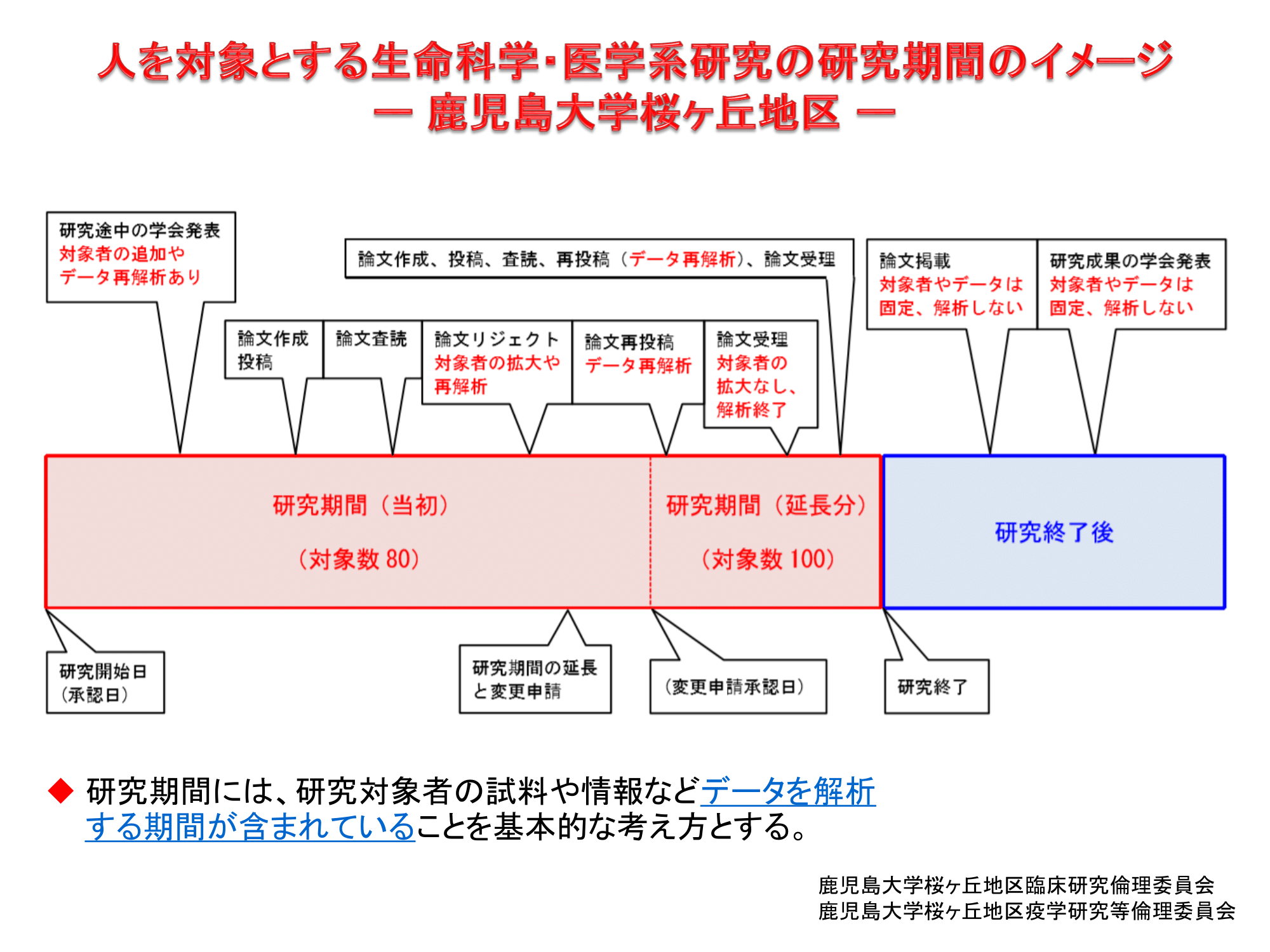
人を対象とする生命科学・医学系研究の研究期間について
症例報告の倫理審査について
「人を対象とする生命科学・医学系研究に関する倫理指針」上は、症例発表時の倫理審査は必須ではございません。まずは発表する学会や雑誌等のルール・投稿規程等をご確認いただきますようお願い申し上げます。
ご案内(PDFダウンロード_学内のみ)
| 倫理審査申請書(症例報告用) |
各種様式について
書類作成前に、本ページ内(上にスクロール)の各項で必要書類をご確認ください。各項の「提出書類一式はこちら(ZIP)」より申請内容別にまとめてダウンロード可能です。まとめてダウンロードを希望しない場合に、下記より個別に様式をダウンロードすることが可能です。

 HOME
HOME 病院紹介
病院紹介 受診される方へ
受診される方へ 医療関係者の方へ
医療関係者の方へ 診療科案内
診療科案内 部門案内
部門案内 よくある質問
よくある質問 お問合せ
お問合せ アクセス・駐車場
アクセス・駐車場










